Distúrbios da pleura – Steven A Sahn
Steven A. Sahn, M.D., F.A.C.P.
Professor of Medicine and Director. Division of Pulmonary, Critical Care, Allergy and Sleep Medicine. Medical University of South Carolina. Charleston, South Carolina.
Artigo original: Sahn SA. Disorders of the pleura. ACP Medicine. 2007;1-18.
[The original English language work has been published by DECKER INTELLECTUAL PROPERTIES INC. Hamilton, Ontario, Canada. Copyright © 2011 Decker Intellectual Properties Inc. All Rights Reserved.]
Tradução: Soraya Imon de Oliveira
Revisão técnica: Dr. Euclides Furtado de Albuquerque Cavalcanti
As efusões pleurais podem ser causadas por uma doença local (como infecção, inflamação ou malignidade), que ocorra no tórax ou em outra região, doenças sistêmicas e fármacos. Devido à ampla gama de possíveis causas, não surpreende a estimativa de 1,4 milhão de pessoas desenvolvendo efusões pleurais anualmente, nos Estados Unidos.1 Cerca de 2/3 destes pacientes apresentam efusões decorrentes de insuficiência cardíaca (IC), pneumonia, malignidade ou embolia pulmonar.
A suspeita de derrame pleural pode ser levantada com base nos achados do exame físico ou de uma radiografia torácica de rotina. Quando a existência de um derrame pleural é confirmado, é comum se realizar uma toracocentese diagnóstica. Diante da existência de uma efusão de proporções moderadas e fluxo desimpedido, o exame físico é capaz de orientar com segurança a inserção da agulha de toracocentese. Contudo, a ultrassonografia pleural deve ser obtida sempre que a inserção da agulha for motivo de preocupação. Um número crescente de pneumologistas tem usado a ultrassonografia pleural como rotina, para guiar a toracocentese. Esta prática diminui significativamente a taxa de complicações, sobretudo a ocorrência de pneumotórax.2
Nem todo derrame pleural requer uma toracocentese imediata. Exemplificando, o paciente com uma apresentação clássica de IC pode ser manejado inicialmente com tratamento e observação. Contudo, no caso do paciente que apresenta aspectos atípicos de IC (p. ex., tórax pleurítico, febre, derrame pleural esquerdo unilateral e tamanho normal do coração), a toracocentese deve ser realizada sem demora para excluir efusão parapneumônica ou embolia pulmonar concomitantes. Se o paciente estiver sob suspeita de pleurisia viral e apresentar um derrame pleural mínimo, o tratamento apropriado consiste em observação.
A análise do líquido pleural isolada não permite estabelecer um diagnóstico específico. Entretanto, quando combinada à obtenção de uma história direcionada, exame físico completo e realização de radiografia ou tomografia computadorizada (TC) torácicas, o valor diagnóstico da toracocentese aumenta de modo significativo. A existência de um derrame pleural implica na alteração do equilíbrio fisiológico normalmente existente entre formação e reabsorção do líquido pleural, enquanto as características específicas do derrame pleural podem sugerir o diagnóstico clínico. A avaliação de um paciente com derrame pleural começa pela obtenção de uma história detalhada, realização do exame físico e solicitação dos exames laboratoriais associados, cuja combinação ajuda o clínico a formular um diagnóstico antes de a toracocentese ser realizada. A análise do líquido pleural sem dúvida é mais útil neste contexto.
Abordagem do paciente com derrame pleural
História e exame físico
Os pacientes que apresentam um derrame pleural podem ser assintomáticos, como é o caso daqueles com derrame pleural reumatoide ou efusão pleural por asbestos benigna (EPAB) [Tabela 1]. Entretanto, existem certas condições cuja apresentação quase sempre está associada à formação de efusões pleurais sintomáticas. Estas condições incluem a pneumonia e a pleurite lúpica [Tabela 2].
Tabela 1. Efusões pleurais tipicamente assintomáticas
|
EPAB |
|
Hipoalbuminemia |
|
Síndrome nefrótica |
|
Diálise peritoneal |
|
Pleurisia reumatoide |
|
Pulmão encarcerado |
|
Urinotórax |
|
Síndrome da unha amarela |
EPAB = efusão pleural por asbestos benigna.
Tabela 2. Efusões pleurais tipicamente sintomáticas
|
Pneumonia bacteriana |
|
Efusão pleural carcinomatosa |
|
IC |
|
Pleurisia lúpica |
|
Mesotelioma maligno |
|
SLPC |
|
Embolia pulmonar |
IC = insuficiência cardíaca; SLPC = síndrome da lesão pós-cardíaca.
Os sintomas mais comuns em pacientes com derrame pleural são a dispneia e a dor torácica. A dispneia pode ser observada em um paciente com efusão ampla ou maciça e pulmões normais, ou em um indivíduo com efusão pequena a moderada e doença pulmonar subjacente. A presença de uma efusão ampla ou maciça causa deslocamento mediastínico contralateral, movimentação para fora da parede torácica ipsilateral, compressão pulmonar e descompressão do hemidiafragma ipsilateral. Foi hipotetizado que os pacientes que apresentam uma efusão ampla ou maciça sentem falta de ar em consequência da diminuição da complacência da parede torácica aliada ao aumento da sinalização oriunda dos receptores neurogênicos localizados nos pulmões.3 Em contraste, a existência de um derrame pleural pequeno a moderado provoca deslocamento do pulmão e exerce um efeito clinicamente insignificante sobre a função pulmonar.
A dor torácica associada ao derrame pleural é causada pela inflamação da pleura.4 O grau de inflamação e a intensidade da dor torácica parecem estar diretamente relacionados. Os pacientes com dor torácica pleurítica descrevem-na como uma pontada na região lateral ou como uma dor do tipo lancinante ou penetrante. Esta dor geralmente é exacerbada pela inspiração profunda, tosse ou espirro. A dor torácica pleurítica pode ser minimizada pela compressão da parede torácica. No entanto, trata-se de um achado inespecífico, que não ajuda a diferenciar a inflamação pleural de outras possíveis causas de dor torácica, como uma fratura de costela, por exemplo.
A dor torácica pleurítica pode ser localizada sobre a área de inflamação pleural ou pode ser uma dor refletida.4 Mais comumente, esta dor permanece localizada no sítio de inflamação pleural costal. Quando áreas localizadas nas regiões lateral, anterior e posterior do diafragma estão inflamadas, a dor costuma ser sentida de maneira difusa sobre a parte inferior do tórax, nas costas e no abdome. Quando a inflamação envolve o diafragma central, a dor é refletida para a região cervical posterior ipsilateral, ombro e músculo trapézio. Isto ocorre porque as fibras sensoriais do nervo frênico entram na medula espinal ao nível de C4, que constitui o ponto de entrada habitual das sensações que chegam dos ombros.4
Como a dispneia e a dor torácica são sintomas inespecíficos, outros aspectos da história médica são importantes para estreitar o diagnóstico diferencial. A IC é sugerida, quando se observa uma ortopneia associada, dispneia paroxística noturna e edema periférico. Uma história de perda da consciência e febre relatada por um paciente dependente de álcool sugere a existência de um empiema anaeróbio. Um derrame pleural unilateral detectado em um trabalhador de estaleiro é sugestiva de EPAB. A síndrome da lesão pós-cardíaca (SLPC) deve ser considerada em casos de pacientes que, decorridas 3 semanas da cirurgia cardíaca, apresentem febre, dispneia e dor torácica pleurítica do lado esquerdo.5 O diagnóstico de pleurite induzida por lúpus medicamentoso deve ser considerado em casos de pacientes que tenham usado procainamida no último ano.6 Um número crescente de fármacos está associado à ocorrência de efusões pleurais, e, por este motivo, o clínico que se depara com uma efusão exsudativa não diagnosticada deve rever com cuidado a terapia farmacológica estabelecida para o paciente, a fim de determinar se o derrame pleural observado é fármaco-induzido.7
Imagem torácica
A radiografia do tórax pode fornecer indícios diagnósticos adicionais que sejam sugestivos da causa do derrame pleural.6 Quando a radiografia torácica mostra a presença de uma efusão pleural solitária, o clínico deve considerar causas como pleurisia viral, efusão pleural tuberculosa ou uma pneumonia bacteriana limitada obscurecida pelo derrame pleural. As efusões pleurais decorrentes de pleurite lúpica ou doença reumática também podem ocorrer como um derrame pleural isolado. Outros diagnósticos a serem considerados diante da observação de um derrame pleural solitário incluem o câncer metastático, EPAB, embolia pulmonar, doença pleural fármaco-induzida e síndrome da unha amarela. É mais provável que uma efusão pleural maciça acompanhada de deslocamento mediastínico contralateral represente um câncer metastático oriundo de uma lesão primária localizada fora do pulmão. Um derrame pleural amplo ou maciço, que cause deslocamento ipsilateral, sugere a existência de um câncer de pulmão envolvendo o tronco bronquial principal ipsilateral. Uma efusão ampla ou maciça sem o deslocamento contralateral sugere a existência de um mesotelioma pleural maligno.
As efusões localizadas abaixo do diafragma podem ser transudatos produzidos por um hidrotórax hepático ou diálise peritoneal, mas também podem ser exsudatos causados por uma pancreatite (aguda ou crônica) ou por um abscesso subfrênico ou esplâncnico.
As efusões pleurais bilaterais são mais comumente transudatos resultantes de IC, estados hipoalbuminêmicos ou pericardite constritiva. A maioria das efusões exsudativas bilaterais com uma silhueta cardíaca normal é maligna. Entretanto, este tipo de efusão também pode ser observado em pacientes com pleurite lúpica. Um derrame pleural acompanhado de infiltrados intestinais pode ser decorrente de IC, artrite reumatoide ou carcinomatose linfangítica. A presença de nódulos pulmonares acompanhando as efusões pleurais é sugestiva de câncer metastático, granulomatose de Wegener, doença reumatoide e êmbolos sépticos.
Análise do líquido pleural
A análise do líquido pleural, quando combinada à obtenção de uma história detalhada, realização de exame físico e radiografia, deve possibilitar ao clínico estabelecer um diagnóstico definitivo ou seguro para quase todos os pacientes. É provável que o verdadeiro número de efusões pleurais não diagnosticadas esteja superestimado na literatura. Um derrame pleural pode escapar à detecção pelos seguintes motivos: (1) a história do paciente é apenas parcialmente conhecida; (2) nem todos os exames pertinentes foram realizados; e (3) o conhecimento do clínico acerca da doença pleural é insuficiente. O percentual de efusões pleurais não diagnosticadas seria extremamente baixo se os médicos conhecessem melhor a doença pleural e a análise de líquido pleural.
Observação
Para alguns pacientes, o diagnóstico pode ser confirmado por métodos de cabeceira, pela inspeção do líquido pleural, à medida que este vai sendo retirado do espaço pleural [Tabela 3].9 A cor, o aspecto e o odor do líquido podem ser diagnósticos.
Tabela 3. Características físicas do LP que podem sugerir um diagnóstico
|
Característica |
Diagnóstico sugerido |
|
Cor do líquido |
|
|
Amarelo-claro (cor-de-palha) |
Transudato clássico, exsudato paucicelular |
|
Vermelho (cor-de-sangue) |
Malignidade, EPAB, SLPC, infarto pulmonar, traumatismo |
|
Branco (leitoso) |
Quilotórax ou efusão de colesterol |
|
Marrom |
Efusão sanguinolenta de longa duração, ruptura de abscesso hepático amébico |
|
Preto |
Infecção por Aspergillus |
|
Amarelo-esverdeado |
Pleurisia reumatoide |
|
Verde |
Fístula bi-iliopleural |
|
Consistência do líquido |
|
|
Purulento |
Empiema |
|
Viscoso |
Mesotelioma |
|
Debris |
Pleurisia reumatoide |
|
Turvo |
Exsudato inflamatório ou efusão lipídica |
|
Patê de anchovas |
Ruptura de abscesso hepático amébico |
|
Aquoso |
Fístula duropleural |
|
Odor do líquido |
|
|
Pútrido |
Empiema anaeróbio |
|
Amoniacal |
Urinotórax |
Exsudatos e transudatos
A discriminação entre transudatos e exsudatos constitui um importante ponto de partida diagnóstico na análise do líquido pleural.10,11 Os transudatos são numericamente limitados e representam desequilíbrios das pressões hidrostática e oncótica em pacientes com membrana pleural normal [Tabela 4]. Os exsudatos são mais comuns e estão associados a diversas doenças, ente as quais infecção, inflamação, malignidade e anormalidades linfáticas [Tabela 5]. A importância prognóstica das efusões exsudativas frequentemente justifica a realização de exames diagnósticos adicionais para determinação de sua causa subjacente. Em contraste, no caso das efusões transudativas, a apresentação clínica do paciente costuma ser suficiente para determinar a causa subjacente.
Tabela 4. Causas de efusões pleurais transudativas
|
Diagnóstico |
Comentários |
|
IC |
A diurese aguda pode aumentar as concentrações e proporções de proteínas e DHL no LP |
|
Cirrose |
As efusões são raras na ausência de ascite clínica; a maioria ocorre no lado direito |
|
Síndrome nefrótica |
Efusões pleurais de pequenas proporções. Considere o diagnóstico de embolia pulmonar, se a efusão for unilateral ou bilateral com proporções distintas, hemorrágica ou com predominância de PMN |
|
Diálise peritoneal |
Efusões pequenas, que ocorrem no lado direito ou são bilaterais. Em raros casos, surgem efusões amplas ou maciças no lado direito, dentro de 48 horas após o início da diálise |
|
Hipoalbuminemia |
Efusões pequenas e bilaterais, associadas à anasarca (albumina < 1,7 g/dL) |
|
Urinotórax |
Efusão unilateral produzida por uma uropatia obstrutiva ipsilateral |
|
Atelectasia |
Efusão pequena, produzida por uma pressão negativa intrapleural aumentada. É comum em pacientes de UTI e após as cirurgias de revascularização coronariana |
|
Pericardite constritiva |
Efusões bilaterais, em que o tamanho do coração é normal |
|
Pulmão encarcerado |
Efusão unilateral decorrente do desequilíbrio das pressões hidrostáticas provocado por um processo inflamatório remoto |
|
Obstrução da veia cava superior |
É causada pela hipertensão venosa sistêmica aguda ou por uma obstrução linfática inicial |
|
Fístula duropleural |
Vazamento do LCE para dentro do espaço pleural. Na maioria dos casos, é causada por traumatismo |
|
Migração extravascular de um CVC |
Pode ocorrer com infusões de salina ou glicose |
CVC = cateter venoso central; IC = insuficiência cardíaca; LCE = líquido cerebrospinal; DHL = lactato desidrogenase; LP = líquido pleural; PMN = neutrófilo polimorfonuclear; UTI = unidade de terapia intensiva.
Tabela 5. Causas de efusões pleurais exsudativas
|
Infecciosas |
Pneumonia bacteriana |
|
Pleurisia tuberculosa | |
|
Doença fúngica | |
|
Pneumonias atípicas | |
|
Nocardia, Actinomyces | |
|
Abscesso hepático | |
|
Abscesso esplênico | |
|
Hepatite | |
|
Ruptura esofágica espontânea | |
|
Parasitas | |
|
Iatrogênicas |
Fármaco-induzida |
|
Perfuração esofágica | |
|
Escleroterapia esofágica | |
|
Migração extravascular de um CVC | |
|
Tubo de alimentação entérica adentrando o espaço pleural | |
|
Malignas |
Carcinoma |
|
Linfoma | |
|
Mesotelioma | |
|
Leucemia | |
|
Quilotórax | |
|
Outros processos inflamatórios |
Pancreatite |
|
EPAB | |
|
Infarto pulmonar | |
|
Radioterapia | |
|
Pleurisia urêmica | |
|
Sarcoidose | |
|
SLPC | |
|
Hemotórax | |
|
SARA | |
|
Pressão intrapleural negativa aumentada |
Atelectasia |
|
Encarceramento pulmonar | |
|
Efusão de colesterol | |
|
Doença do tecido conectivo |
Pleurite lúpica |
|
Pleurisia reumatoide | |
|
Doença mista do tecido conectivo | |
|
Síndrome de Churg-Strauss | |
|
Granulomatose de Wegener | |
|
Febre Familiar do Mediterrâneo | |
|
Disfunção endócrina |
Hipotireoidismo |
|
Síndrome da hiperestimulação ovariana | |
|
Anormalidades linfáticas |
Malignidade |
|
Síndrome da unha amarela | |
|
LAM (quilotórax) | |
|
Linfangiectasia | |
|
Movimento de líquido do abdome para o espaço pleural |
Pancreatite aguda |
|
Síndrome de Meigs | |
|
Carcinoma | |
|
Ascite quilosa | |
|
Urinotórax |
CVC = cateter venoso central; EPAB = efusão pleural por asbestos benigna; LAM = linfangioleiomiomatose; SARA = síndrome da angústia respiratória aguda; SLPC = síndrome da lesão pós-cardíaca.
Em casos que envolvem efusões exsudativas, a pleura está anormal. Por isso, a concentração de proteínas de alto peso molecular é maior no líquido do exsudato do que no líquido do transudato. Baseando-se em metanálises com utilização da análise característica operacional do receptor (ROC – em inglês, receiver operating characteristic), diversos valores de corte tem sido utilizados para discriminar exsudatos e transudatos. Os seguintes valores sugerem que o derrame pleural é um exsudato:
Proporção entre proteínas do líquido pleural e proteínas do soro acima de 0,5.
Níveis de lactato desidrogenase (DHL) no líquido pleural acima de 0,67% (2/3) do limite máximo dos valores séricos normais.
Nota dos Editores do MedicinaNet – também são bastante utilizados os conhecidos “Critérios de Light”, que além dos 2 fatores discriminantes acima incluem também a proporção de níveis de DHL no líquido pleural e níveis no soro acima de 0,6. No entanto, a adição deste terceiro critério parece acrescentar pouco, pois este critério se relaciona bastante com os níveis de DHL > 2/3 do limite superior do método (fonte: www.uptodate.com).
Estes valores de corte apresentam alta sensibilidade (98%) e, contudo, moderada especificidade (74%) para identificação de efusões exsudativas.12 Outras pesquisas que utilizam a análise ROC sugerem que a maior sensibilidade e especificidade para detecção de um exsudato (ou seja, a área sob a curva [ASC]; 0,89) consiste em níveis de DHL no líquido pleural maiores que o equivalente a 0,82% do limite superior dos níveis séricos normais de DHL.13
Um número significativo de efusões são discordantes – ou seja, o líquido é identificado como exsudato com base apenas em um dos critérios de proteínas ou DHL, mas não em ambos. Os exemplos incluem quilotórax (exsudato, considerando apenas as proteínas) e pneumonia por Pneumocystis jiroveci (exsudato, considerando apenas a DHL). Na minha experiência, tenho observado que, quando os valores de proteínas e DHL se aproximam dos valores de corte para transudato, a efusão pode ser tanto um transudato como um exsudato. Entretanto, se um destes valores é significativamente maior do que o valor de corte, aumenta a probabilidade de a efusão ser um exsudato. Ao contrário, se um dos valores é significativamente menor do que o valor de corte, aumenta a probabilidade de a efusão ser um transudato.
Os níveis de proteínas totais e de DHL também podem ajudar a estreitar o diagnóstico diferencial dos distúrbios que poderiam ser a causa subjacente de uma efusão exsudativa.9 Exemplificando, a concentração total de proteínas é quase sempre maior que 4 g/dL em um derrame pleural por tuberculose. Em contraste, uma ampla gama de concentrações de proteínas totais é encontrada em efusões associadas a malignidades e efusões paraneoplásicas. Nos casos de macroglobulinemia de Waldenström e mieloma múltiplo, a concentração total de proteínas muitas vezes é maior que 7 g/dL. No exsudato discordante, cujo líquido pleural apresenta níveis de DHL na faixa exsudativa e uma concentração proteica total na faixa transudativa, o diagnóstico diferencial inclui malignidade, efusão parapneumônica e pneumonia por Pneumocystis jiroveci. Quando a concentração de DHL no líquido pleural excede o equivalente ao triplo do limite superior dos níveis séricos normais de DHL, um empiema ou efusão parapneumônica complicada (EPC), derrame pleural reumatoide e paragonimíase pleural devem ser considerados como causas possíveis.
Contagem de células nucleadas e diagnóstico diferencial
Uma contagem total de células nucleadas da ordem de 1.000/mcL constitui o típico valor de corte para transudatos e exsudatos: efusões com contagens de células totais abaixo deste valor são transudatos; aquelas com contagens acima deste valor são exsudatos. Quando a contagem de células nucleadas excede 10.000/mcL, os possíveis diagnósticos a serem considerados incluem as efusões parapneumônicas, pancreatite aguda, abscesso subdiafragmático e infartos hepático e esplênico. Quando as contagens de células nucleadas ultrapassam 50.000/mcL, o diagnóstico diferencial é limitado a uma EPC, incluindo empiema; pancreatite aguda; e infarto pulmonar maciço. Entretanto, no empiema, a contagem de células nucleadas também pode ser extremamente baixa (isto é, abaixo de 200 neutrófilos), se a maioria dos neutrófilos tiver sofrido autólise em decorrência da baixa tensão de oxigênio e da acidose do líquido pleural.1,11,14
Nas efusões exsudativas crônicas, as contagens de células nucleadas frequentemente são menores que 5.000/mcL, enquanto as causas mais comuns são a malignidade e a efusão pleural tuberculosa.
O momento da realização da toracocentese em relação ao aparecimento da lesão pleural aguda determina a população celular predominante. A resposta celular inicial à lesão pleural é neutrofílica, sendo que a principal molécula quimiotática encontrada no espaço pleural é a interleucina-8 (IL-8). Com o passar do tempo desde o aparecimento da lesão aguda, a população celular muda. Em poucos dias após a cessação do processo agudo, as células mononucleares passam a predominar. Quando a lesão persiste por mais de 2 semanas, os linfócitos passam a constituir a população celular predominante. Desta forma, em casos de pneumonia bacteriana aguda, embolia pulmonar aguda com infarto e pancreatite aguda – condições que levam os pacientes a procurarem tratamento médico ainda no início do curso clínico do distúrbio –, a efusão é predominantemente neutrofílica. Nas doenças de início insidioso (p. ex., malignidade e tuberculose), é esperado que o exsudato apresente predominância de linfócitos. A população celular presente nas efusões transudativas é composta de linfócitos, macrófagos e células mesoteliais. Os neutrófilos quase sempre estão ausentes nos transudatos. Se, em vez disso, houver neutrófilos em uma efusão transudativa, então o achado será sugestivo da existência de 2 condições subjacentes, como IC e uma efusão parapneumônica.
Linfocitose de líquido pleural. O diagnóstico diferencial de uma efusão exsudativa é limitado quando a população de linfócitos ultrapassa 80% do total de células nucleadas [Tabela 6].15 Dentre estas efusões, as mais comuns são as efusões pleurais tuberculosas, de quilotórax e de linfoma. Na maioria das efusões exsudativas, as populações de linfócitos são menores que 80% da contagem total de células nucleadas. Populações de linfócitos menores que 50% do total raramente são encontradas. Em pacientes com linfoma, a população de linfócitos é consistentemente maior que 80% da contagem de células nucleadas total. Em contraste, o percentual de linfócitos em casos de carcinoma pleural metastático costuma ser de 50 a 70% do total de células nucleadas.
Tabela 6. Efusões pleurais exsudativas com predominância de linfócitos*
|
Doença |
Comentários |
|
Efusão pleural tuberculosa |
Causa mais comum de exsudatos com predominância de linfócitos; habitualmente, contém 90 a 95% de linfócitos |
|
Quilotórax |
2.000 a 20.000 linfócitos/mcL; sua causa mais comum é o linfoma |
|
Linfoma |
Frequentemente, 100% das células nucleadas são linfócitos; o rendimento diagnóstico da citologia ou biópsia pleural é maior em casos de Linfoma não-Hodgkin |
|
Síndrome da unha amarela (crônica) |
Uma causa de efusão pleural persistente. |
|
Pleurisia reumatoide |
Comumente associada ao encarceramento do pulmão. |
|
Sarcoidose |
Habitualmente, > 90% de linfócitos; exsudato discordante (apenas critérios de proteína). |
|
Rejeição aguda de pulmão |
Efusão nova ou aumentada em 2 a 6 semanas após o transplante |
|
Cirurgia de revascularização miocárdica |
Ocorre passados mais de 2 meses da realização da cirurgia; pode levar ao desenvolvimento de encarceramento do pulmão. |
*Nestas efusões, os linfócitos representam 80% da contagem celular.
Eosinofilia do líquido pleural (ELP). A eosinofilia do líquido pleural (ELP) é definida por uma contagem de eosinófilos no líquido pleural acima de 10% do total de células nucleadas. Sua presença frequentemente sugere uma doença autolimitada benigna e na maioria das vezes está associada à existência de ar ou sangue no espaço pleural. A patogênese é desconhecida, contudo foi hipotetizado que os eosinófilos da medula óssea são atraídos para o espaço pleural por ação do fator quimiotático IL-5.
Algumas condições podem causar ELP [Tabela 7].15 Embora seja tipicamente benigna, a existência de ELP não exclui o diagnóstico de malignidade. De fato, estudos demonstraram que a prevalência de malignidades é similar nas efusões pleurais com e sem eosinofilia.16 A pleurite eosinofílica constitui um achado inicial em pacientes que desenvolvem pneumotórax espontaneamente. Contudo, em pacientes com hemotórax, os eosinófilos não aparecem no espaço pleural durante 7 a 14 dias.17 Após um traumatismo, a eosinofilia pode se desenvolver no líquido pleural associada ao desenvolvimento de eosinofilia no sangue periférico. Nestes casos, os eosinófilos não são eliminados do sangue antes de a ELP ser completamente resolvida. Quando um paciente com história de exposição a asbestos apresenta uma efusão pleural eosinofílica, a possibilidade de EPAB deve ser considerada no diagnóstico diferencial.
Tabela 7. Causas de ELP*
|
Doença |
Comentário |
|
Pneumotórax |
Efusão em 10 a 20% dos casos; desenvolvimento precoce de eosinofilia tecidual e de ELP |
|
Hemotórax |
A ELP surge em 10 a 14 dias após o desenvolvimento de hemotórax |
|
Asbestose benigna |
A incidência de ELP é de 30%; até 50% de eosinófilos/total de células nucleadas |
|
Embolia pulmonar |
Associado ao infarto pulmonar e hemorragia no espaço pleural |
|
Doença parasítica |
Paragonimíase, doença hidática, amebíase, ascariose |
|
Doença fúngica |
Histoplasmose, coccidioidomicose (15% com ELP) |
|
Fármaco-induzida |
Dantroleno, bromocriptina, nitrofurantoína, ácido valproico |
|
Linfoma |
Mais frequentemente, a doença de Hodgkin |
|
Carcinoma |
A incidência de ELP é de 5 a 8% |
|
Síndrome de Churg-Strauss |
As contagens de eosinófilos no LP estão elevadas; associação com a eosinofilia no sangue |
|
Efusão pleural tuberculosa |
Rara |
|
Sarcoidose |
Rara |
*A eosinofilia está presente quando a contagem de eosinófilos no LP ultrapassa 10% do total de células nucleadas existentes no LP.
ELP = eosinofilia de líquido pleural; LP = líquido pleural.
Se um grande número de plasmócitos for observado no líquido pleural, a possibilidade de mieloma múltiplo com envolvimento pleural deve ser fortemente considerada como causa subjacente. O achado de alguns basófilos no líquido pleural é destituído de importância clínica. Mas quando os basófilos representam mais de 10% das células nucleadas, é provável que haja envolvimento pleural leucêmico.
Análise bioquímica do líquido pleural
pH. A acidose do líquido pleural é definida por um pH menor que 7,3 e por no mínimo 0,15 unidades de pH a menos do que o pH do sangue arterial periférico. Quando a acidose de líquido pleural é documentada em determinado paciente, o diagnóstico diferencial da efusão exsudativa é limitado.9,18 [Tabela 8]. Para ter importância clínica, o nível de pH precisa ser medido com um pHmetro (isto é, sistema de radiometria), pois o método da vareta medidora de nível ou outra forma de medição aberta fornecem valores falsos.
Tabela 8. Incidência e faixa de pH baixo em doenças com acidose de LP (pH < 7,3)
|
Doença |
Incidência Estimada de pH < 7,3 (%) |
Faixa de pH |
Comentários |
|
Efusão parapneumônica, sem complicação |
< 5 |
7,45 a 7,3 |
Líquido não purulento e não loculado, negativo para bacteriologia; é resolvida apenas com o uso de antibióticos |
|
EPC/empiema |
~ 100 |
7,29 a 5 |
Requer drenagem do espaço pleural para resolução |
|
Ruptura esofágica |
~ 100 |
6,8 a 5 |
pH = 6 e níveis elevados de amilase salivar são achados diagnósticos |
|
Pleurisia reumatoide (crônica) |
~ 100 |
7,15 a 6,8 |
Associada a níveis de glicose < 30 mg/dL e a níveis de LDH > 1.000 UI/L |
|
Efusão maligna |
30 a 40 |
7,5 a 6,9 |
pH < 7,3: sobrevida pior, maior rendimento do exame citológico e biópsia pleural, resposta mais fraca à pleurodese |
|
Pleurisia lúpica |
15 a 20 |
7,4 a 6,85 |
Associada a uma baixa concentração de glicose no LP; diagnóstico estabelecido pela presença de células LE no LP ou por uma concentração de ANA maior no LP do que no soro |
|
Efusão pleural tuberculosa |
10 a 20 |
7,4 a 6,95 |
Associada a uma baixa concentração de glicose no LP; o pH, quando baixo, habitualmente está na faixa de 7,29 a 7,1 |
|
Hemotórax |
< 10 |
7,5 a 7,17 |
Ocorre quando o hematócrito do LP se aproxima do hematócrito do sangue e a pleura apresenta uma lesão grave |
|
Fístula pancreatopleural |
Rara |
7,5 a 7,28 |
Os níveis de amilase no LP muitas vezes estão acima de 100.000 UI/L |
|
Infarto pulmonar |
Rara |
7,52 a 7,29 |
Ocorre diante de um LP grosseiramente sanguinolento e com uma extensiva lesão pleural |
|
Hérnia diafragmática com infarto intestinal |
Relato único |
7,15 |
Os produtos ácidos do intestino morto excedem a capacidade de efluxo dos vasos linfáticos pleurais |
ANA = anticorpo antinúcleo; EPC = efusão parapneumônica complicada; LDH = lactato desidrogenase; LE = lúpus eritematoso; LP = líquido pleural.
O pH do líquido pleural normal é de aproximadamente 7,6, e este valor se deve ao gradiente de bicarbonato existente entre o líquido pleural e o sangue. Um pH abaixo de 7,3 indica um acúmulo substancial de íons de hidrogênio. Existem 2 mecanismos responsáveis pela acidose do líquido pleural: (1) aumento da produção de ácidos pelas células e bactérias encontradas no líquido pleural (p. ex., como ocorre no empiema e na EPC); e (2) diminuição do efluxo de íons hidrogênio a partir do espaço pleural, consequente a uma membrana pleural anormal (p. ex., como ocorre na pleurisia reumatoide crônica e em casos de malignidade).
As 2 causas mais comuns de transudatos com pH baixo são as EPC (incluindo o empiema) e as efusões pleurais malignas. A ruptura esofágica e a pleurisia reumatoide crônica, embora sejam apresentações menos comuns, estão quase sempre associadas a um baixo pH de líquido pleural. A pleurite lúpica e as efusões pleurais tuberculosas estão associadas a acidose de líquido pleural em apenas 10 a 20% dos casos. Em casos raros, um pH inferior a 7,3 pode ser causado por hemotórax, efusão pancreática crônica e infarto pulmonar. Ainda mais raramente, uma efusão transudativa com pH baixo pode resultar de urinotórax. Um urinotórax consiste no acúmulo de urina dentro do espaço pleural. Este acúmulo é produzido pelo extravasamento da urina a partir da cápsula renal para dentro do espaço pleural ipsilateral, através de defeitos existentes no diafragma.19
A acidose pleural associada à predominância neutrofílica ocorre nos casos de EPC, ruptura esofágica e pleurite lúpica aguda, enquanto a predominância linfocítica é encontrada em casos de efusão pleural tuberculosa, malignidade e efusão reumatoide crônica.
A acidose do líquido pleural pode fornecer informações diagnósticas e prognósticas, em determinados contextos clínicos. Por exemplifo, pH baixo de líquido pleural associado a uma efusão parapneumônica não purulenta sugere a necessidade de se drenar o espaço pleural para que o processo inflamatório pleural seja adequadamente resolvido.20 Um pH menor que 7,3 com efusão pleural maligna sugere a ocorrência de processo maligno em estágio bastante avançado junto ao espaço pleural. O prognóstico do paciente, neste caso, é pior do que o prognóstico de um paciente com pH = 7,3. Além disso, nos casos em que o pH da efusão maligna é baixo, um resultado positivo no exame citológico do líquido apresenta alta sensibilidade para detecção de malignidades. Um pH de efusão maligna baixo indica uma resposta precária à pleurodese. Entretanto, não representa uma contraindicação absoluta à realização da pleurodese.21-23
Glicose. No estado normal, a concentração de glicose do líquido pleural é equivalente à concentração de glicose no sangue periférico. Esta equivalência se deve ao fato de a glicose ter baixo peso molecular e ser transportada do sangue para o líquido pleural por difusão simples, através das membranas endoteliais-mesoteliais. Todavia, um pequeno grupo de efusões pleurais exsudativas (ou seja, o mesmo grupo de efusões com baixo pH de líquido pleural) apresenta uma baixa concentração de glicose no líquido pleural [Tabela 9].9,24 Uma baixa concentração de glicose é definida por uma proporção entre glicose no líquido pleural e glicose no soro abaixo de 0,5. O empiema e as efusões pleurais reumatoides apresentam a maior incidência de baixa concentração de glicose pleural. Além disso, o empiema e a pleurisia reumatoide crônica são quase as únicas doenças em que a concentração de glicose pode ser nula.
Tabela 9. Incidência e faixa de níveis de glicose no LP em doenças com baixa concentração de glicose
|
Doença |
Incidência estimada de proporções de glicose no LP: glicose no soro < 5 (%) |
Faixa de concentração de glicose (mg/dL) |
Comentários |
|
Pleurisia reumatoide |
85 a 90 |
0 a 118 |
Glicose < 30 mg/dL em 75%; LP apresentando a tríade glicose < 30 mg/dL, pH = 7 e DHL > 1.000 UI/L; pode preceder as manifestações articulares em 3 anos |
|
EPC/empiema |
40 a 50 ~ 100 |
30 a 145 0 a 59 |
O níveis baixos de glicose não são tão sensíveis quanto o pH baixo como marcador, porém a correlação entre glicose e pH é forte |
|
Ruptura esofágica |
40 a 50 |
15 a 120 |
O LP com pH = 6 e níveis elevados de amilase (salivar) é diagnóstico |
|
Efusão maligna |
30 a 40 |
15 a 167 |
Baixa concentração de glicose acompanhada de efusão crônica em casos de malignidade pleural em estágio bastante avançado |
|
Pleurisia lúpica |
20 a 30 |
32 a 160 |
Transiente; associada a uma severa inflamação pleural, células LE diagnósticas e proporção entre ANA no LP/ANA sérico > 1 sugestiva |
|
Efusão pleural tuberculosa |
20 a 30 |
10 a 140 |
Ausência de correlação entre níveis baixos de glicose e curso clínico ou bacteriologia pleural |
|
Urinotórax |
Relato único |
0 a 130 |
Reabsorção tubular renal vs. empiema em um único caso de níveis baixos de glicose |
ANA = anticorpo antinúcleo; EPC = efusão parapneumônica complicada; DHL = lactato desidrogenase; LE = lúpus eritematoso; LP = líquido pleural.
A patogênese da baixa concentração de glicose no líquido pleural resulta da atividade metabólica aumentada dos neutrófilos e bactérias presentes no líquido, acompanhada do aumento da glicólise (como se observa no empiema e nas EPC) e do comprometimento da movimentação da glicose no espaço pleural, em decorrência da membrana pleural anômala (como ocorre na pleurisia reumatoide).
Em certas circunstâncias, a concentração de glicose no líquido pleural pode exceder bastante a concentração de glicose no sangue periférico. Este fenômeno pode ser observado em pacientes com ruptura esofágica que continuam a beber líquidos contendo glicose (p. ex., refrigerantes), bem como em pacientes que estejam recebendo infusão de glicose através de um cateter venoso central (CVC) que tenha saído da veia.
Amilase. Um aumento dos níveis de amilase no líquido pleural é definido por um valor maior que o limite máximo dos níveis normais de amilase no soro. Como alternativa, consiste em uma proporção entre amilase de líquido pleural e amilase sérica maior que 1. Um aumento dos níveis de amilase no líquido pleural ocorre em casos de doença pancreática, ruptura esofágica e malignidade.25,26 Há relatos raros de efusões pleurais ricas em amilase encontradas em pacientes com pneumonia e com gestação ectópica rompida.
Na pancreatite aguda, a efusão quase sempre resulta do contato direto das enzimas pancreáticas com a pleura diafragmática e a subsequente movimentação de líquido pancreático para dentro do espaço pleural, via defeitos existentes no diafragma. A lenta depuração da amilase pelos linfáticos pleurais, em comparação à depuração rápida da amilase sérica pelos rins, resulta no aumento da proporção entre amilase no líquido pleural e amilase sérica. Os níveis de amilase no líquido pleural são modestos na pancreatite aguda, em comparação aos níveis de amilase encontrados em uma efusão pleural pancreática crônica. Nas efusões pancreáticas crônicas, o líquido pleural pode mover-se seguindo uma trajetória fistulosa, a partir de um pseudocisto e diretamente para dentro do espaço pleural. Como alternativa, o líquido pode entrar no espaço pleural através de uma ruptura na pleura parietal mediastinal. Em ambos os casos, estes pacientes podem apresentar concentrações de amilase no líquido pleural superiores a 100.000 UI/L.
Cerca de 10 a 15% dos pacientes com efusão pleural maligna apresentam um líquido pleural rico em amilase. Nestes pacientes, o tipo predominante de amilase é do isótipo salivar.26,27 As malignidades mais comumente associadas às efusões pleurais ricas em amilase são os adenocarcinomas do pulmão e do ovário. Linfoma, leucemia e câncer de pulmão (exceto os adenocarcinomas) também foram descritos como estando associados a efusões pleurais ricas em amilase do isótipo salivar.
Lipídios. Quando a cor do líquido pleural é branca ou leitosa e a possibilidade de empiema foi excluída, o líquido pode ser um quilotórax ou uma efusão de colesterol associada [Tabela 10]. As apresentações clínicas de um quilotórax e de uma efusão pleural de colesterol são bastante diferentes: o primeiro manifesta-se de modo agudo ou subagudo e é acompanhado de dispneia, enquanto a outra consiste em uma efusão crônica que se desenvolve ao longo de vários anos, como resultado do aprisionamento ou da falha de um pulmão em se expandir secundários a um processo inflamatório (p. ex., tuberculose ou pleurisia reumatoide).
Tabela 10. Diferenciação entre quilotórax e efusão pleural de colesterol
|
|
Quilotórax |
Efusão Pleural de Colesterol |
|
Incidência |
Incomum |
Rara |
|
Causas |
LNH, trauma, cirurgia, LAM |
Aprisionamento do pulmão: TB, AR, empiema |
|
Aparecimento |
Agudo a subagudo |
Insidiosa; presente durante vários anos |
|
Sintomas |
Dispneia |
Nenhum; dispneia |
|
Aspecto |
Soroso, leitoso, sanguinolento |
Leitosa; brilho acetinado |
|
Análise do líquido pleural |
Exsudato com predominância de linfócitos (= 80%) |
Col:TG > 1; exsudato com predominância de neutrófilos; proteínas > 5 g/dL |
|
Diagnóstico |
TG > 110 mg/dL; quilomícrons; colesterol = 60 a 200 mg/dL |
Colesterol > 200 mg/dL (faixa de 300 a 1.500); cristais de colesterol; com frequência, TG > 110 |
|
Tratamento |
Doença subjacente; pleurodese |
Observação; descorticação |
Col:TG = proporção colesterol:triglicerídeos; LAM = linfangioleiomiomatose; LNH = linfoma não Hodgkin; AR = artrite reumatoide; TB = tuberculose; TG = triglicerídeos.
Na distinção entre quilotórax e efusão de colesterol, a determinação da concentração de triglicerídeos (TG) deve ser o primeiro exame diagnóstico a ser realizado. O diagnóstico de um quilotórax é altamente provável, se a concentração de TG ultrapassar 110 mg/dL, mas será bastante improvável diante de uma concentração de TG menor que 50 mg/dL.28 Quando a concentração de TG estiver entre 50 e 110 mg/dL, o líquido pleural deve ser testado quanto à presença de quilomícrons. A presença de quilomícrons confirma o diagnóstico de quilotórax, pois implica no vazamento de quilo a partir do ducto torácico (ou um de seus principais aferentes) para dentro do espaço pleural.
A análise do líquido pleural de um quilotórax caracteriza-se por uma contagem de células nucleadas total maior que 80% da concentração de linfócitos e por um exsudato discordante, cuja concentração proteica total diminui e atinge os níveis correspondentes à faixa transudativa. Ocasionalmente, o líquido pleural associado ao quilotórax não exibe o aspecto leitoso característico [ver Quilotórax, em Exsudatos EPOEV, adiante].28
Quando o líquido pleural exibe aspecto leitoso e seus níveis de TG estão baixos, é necessário observar se o brilho acetinado está presente, quantificar os níveis de colesterol e avaliar microscopicamente seu sedimento. Ao microscópio, o colesterol é visto como estruturas poliédricas amplas. Se os níveis de colesterol no líquido pleural excederem 200 mg/dL, é mais provável que o líquido represente uma efusão de colesterol.29 Entretanto, níveis altos de colesterol também podem ser encontrados em algumas efusões quilosas. Se houver dúvidas quando ao diagnóstico, deve ser realizada uma análise de quilomícron. Nas efusões de colesterol, a quantificação proteica total varia de 5 a 7 g/dL, sendo que as efusões de colesterol são com frequência predominantemente neutrofílicas. O exemplo clássico de uma efusão de colesterol é aquela produzida pelo aprisionamento do pulmão associado a um processo pleural ativo.30
Adenosina deaminase (ADA). A enzima adenosina deaminase (ADA), encontrada na maioria das células, é importante para a degradação das purinas necessárias à diferenciação das células linfoides. Além disso, a ADA está envolvida na maturação do monócito em macrófago. As concentrações de ADA no líquido pleural estão elevadas nas efusões pleurais tuberculosas. Os testes para detecção de altos níveis de ADA no líquido pleural são de execução simples e de custo relativamente baixo. Em diversos estudos, os valores de corte diagnósticos para ADA variam de 40 a 60 U/L.31,32 Um valor de corte igual a 40 U/L aumenta a sensibilidade do teste, porém diminui sua especificidade, enquanto um valor de corte da ordem de 60 U/L aumenta a especificidade à custa da diminuição da sensibilidade. Quando um valor de corte de 40 U/L é utilizado, a especificidade para efusão pleural tuberculosa diminui, por causa dos níveis altos de ADA que podem ocorrer em outras condições, tais como efusão reumatoide, empiema, mesotelioma, efusão parapneumônica e malignidades hematológicas.
Em geral, a concentração de ADA possui alto valor preditivo negativo para tuberculose. Sua utilidade é maior para 15 a 20% dos pacientes que apresentam pleurisia tuberculosa e resultados negativos em exames diagnósticos padrão (isto é., histologia e cultura pleural negativas). Proporções entre ADA no líquido pleural e ADA sérica superiores a 1 foram observadas não só nas efusões pleurais tuberculosas como também no empiema e na pleurisia reumatoide crônica.
Avaliação para malignidade
Citologia. Uma citologia de líquido pleural positiva tem sido descrita em 40 a 90% dos pacientes com malignidade pleural.31,34 Os pacientes com malignidade apresentam efusões pleurais malignas ou paramalignas. Nas efusões pleurais paramalignas, a citologia de líquido pleural e o exame de biópsia pleural resultam negativos. Em contraste, nas efusões pleurais malignas, o resultado pode ser positivo na citologia, no exame de biópsia ou em ambos.35 As efusões paramalignas resultam de: (1) efeitos locais do tumor (p. ex., pneumonia ou atelectasia obstrutiva); (2) efeitos sistêmicos da malignidade (p. ex., embolia pulmonar); ou (3) complicações da terapia anticâncer (p. ex., pleurite induzida por radioterapia ou por fármacos). O rendimento diagnóstico pode ser amplamente variável, dependendo do tipo de tumor, do número de amostras submetidas, do estágio de envolvimento pleural e do interesse e conhecimentos do citopatologista.
Citometria de fluxo. A citometria de líquido pleural deve ser solicitada diante da possibilidade de a causa da efusão pleural ser um linfoma. A citometria é um teste decisivo nestes casos, devido à sua habilidade de definir a clonalidade de uma população de linfócitos e determinar se as células pertencem à linhagem T ou B.36 Portanto, esta técnica é mais útil em casos de pacientes com exsudatos predominantemente linfocíticos, quando a possibilidade de linfoma deve ser considerada.
Efusões pleurais transudativas
Insuficiência cardíaca (IC)
A IC é causa mais comum de efusões transudativas, bem como de todas as efusões pleurais encontradas em idosos. Em pacientes internados com IC, as efusões pleurais são diagnosticadas por radiografia torácica em 60 a 70% dos casos37 e por TC em quase 90% dos casos.38 A autópsia revela que mais de 90% dos pacientes com IC tinham uma efusão pleural.39 As efusões pleurais estão associadas à hipertensão venosa pulmonar, porém não ocorrem em casos de hipertensão venosa sistêmica isolada.40
Diagnóstico
Os pacientes com IC que apresentam derrame pleural também têm ortopneia e dispneia paroxística noturna. Durante o exame, é possível ouvir crepitações leves junto à base de ambos os pulmões. Uma radiografia torácica tipicamente mostra cardiomegalia e a presença de efusões pleurais bilaterais, com a efusão à direita sendo tipicamente maior do que a da esquerda. Contudo, também há relatos de efusões pleurais unilaterais, que podem ocorrer do tanto lado esquerdo como do lado direito. A severidade do edema pulmonar demonstrada pela radiografia torácica apresenta correlação direta com o volume das efusões pleurais. O líquido tem cor amarelo-clara. Na análise do líquido pleural, menos de 1.000 células mononucleares são observadas e o nível de pH varia de 7,45 a 7,55. Os níveis de proteína e DHL costumam estar na faixa transudativa, mas podem exceder os valores de corte para efusões transudativas após o uso de diuréticos. O diagnóstico geralmente é presumível em casos de pacientes que exibem manifestações clínicas compatíveis e elevação dos níveis de peptídeo natriurético de tipo B (um sinal de IC).
Tratamento
A terapia diurética para controle da IC costuma ser adequada para tratamento do derrame pleural. A efusão é resolvida em geral no decorrer de vários dias ou semanas, conforme a pressão microvascular diminui. A efusão pleural não é resolvida sem que o edema pulmonar tenha desaparecido nas radiografias. A pleurodese unilateral tem sido empregada com sucesso no tratamento de efusões pleurais refratárias.
Hidrotórax hepático
As efusões pleurais desenvolvem-se em cerca de 6% dos pacientes com cirrose de causas diversas e ascite clínica.41,42 Até 20% dos pacientes com hidrotórax hepático não apresentam uma ascite clinicamente demonstrável.43 A patogênese envolve a movimentação do líquido ascítico para dentro do espaço pleural, através de defeitos existentes no diafragma, seguindo um gradiente de pressão.
Diagnóstico
Os pacientes que apresentam hidrotórax hepático exibem os estigmas usuais de cirrose e ascite clínica, além de tipicamente apresentarem dispneia de manifestação insidiosa. Em cerca de 80% dos casos, uma radiografia torácica revela a existência de uma efusão pleural de tamanho pequeno a moderado no lado direito. Contudo, uma efusão unilateral à esquerda é encontrada em 17% dos pacientes, enquanto as efusões bilaterais são observadas em 3% dos pacientes. Uma efusão maciça ocorre em aproximadamente 5% dos pacientes.
A análise do líquido pleural mostra um transudato típico, com predominância de células mononucleares, pH na faixa de 7,45 a 7,55 e concentração de glicose equivalente à concentração de glicose no soro. O diagnóstico é presumido com base na apresentação clínica e nos achados do exame do líquido ascítico. O diagnóstico pode ser confirmado por varredura com radionuclídeo, que evidencia a movimentação do radionuclídeo do espaço peritoneal para o espaço pleural. Este deslocamento costuma ser concluído em 1 a 2 horas, mas pode demorar até 24 horas.
Tratamento
Os pacientes em geral respondem à restrição de sódio, diuréticos de alça e espirinolactona. As efusões refratárias podem ser tratadas com shunt portossistêmico intra-hepático transjugular (DPIT), que reduz a ascite e, assim, ameniza o hidrotórax. A cirurgia toracoscópica vídeo-assistida (CTVA) tem sido utilizada com sucesso para consertar o defeito diafragmático e realizar talcagem. Contudo, esta técnica está associada a morbidade e mortalidade altas. A pleurodese química via tubo torácico apresenta baixo índice de sucesso. A drenagem pleural isolada via tubo torácico é contraindicada, pois pode induzir insuficiência renal aguda e depleção proteica, além de aumentar o risco de infecção pleural.
Pleurite bacteriana espontânea
Diagnóstico
Uma vez excluída a possibilidade de pneumonia, o diagnóstico de pleurite bacteriana espontânea é estabelecido, com base nos achados de febre, contagem absoluta de neutrófilos no líquido pleural acima de 250/mcL e uma cultura de líquido pleural positiva. As efusões associadas à pleurite bacteriana são caracterizadas por uma elevação significativa da concentração de DHL no líquido pleural. Em pacientes com cultura de líquido pleural negativa e um curso clínico compatível, a contagem absoluta de neutrófilos deve ser maior que 500/mcL, antes que seja possível estabelecer um diagnóstico de pleurite bacteriana.
Tratamento
Estes pacientes respondem a antibióticos dirigidos contra bactérias gram-negativas. A drenagem via tubo torácico é contraindicada, a menos que o líquido esteja purulento.
Síndrome nefrótica
Cerca de 20% dos pacientes com síndrome nefrótica desenvolvem efusões pleurais.44 A patogênese dessas efusões envolve uma diminuição da pressão oncótica, consequente a uma hipoalbuminemia severa. O processo pode ou não ser acompanhado de um aumento da pressão microvascular, decorrente da sobrecarga de volume.
Diagnóstico
Os pacientes com efusões pleurais produzidas pela síndrome nefrótica geralmente são assintomáticos. Entretanto, estes pacientes às vezes apresentam dispneia associada à sobrecarga de volume. Uma radiografia torácica tipicamente revela a presença de efusões pleurais pequenas e bilaterais, que com frequência são subpulmonares. O tamanho do coração do paciente pode estar normal, sendo que este aspecto diferencia esta condição de um caso de IC. Na análise do líquido pleural, observa-se que o líquido seroso contém menos de 1.000 células mononucleares, enquanto os níveis proteicos totais estão abaixo de 1 g/dL. O pH é tipicamente maior que 7,45, e os níveis de glicose no líquido pleural são iguais aos níveis de glicose no soro. O diagnóstico é presuntivo.
Tratamento
O tratamento é voltado para a doença subjacente e objetiva maximizar a condição nutricional do paciente. Um importante ponto clínico consiste no fato de estes pacientes serem hipercoaguláveis, como resultado da perda urinária de inibidores de coagulação (p. ex., proteína S e proteína C). A embolia pulmonar pode ocorrer com ou sem trombose de veia renal.45 A possibilidade de embolia pulmonar deve ser considerada em casos de pacientes que apresentam dor torácica pleurítica, quando a efusão é significativamente maior em um hemitórax ou se a análise do líquido pleural revelar a presença de um exsudato hemorrágico com predominância de neutrófilos.
Pulmão encarcerado
Um pulmão encarcerado representa o estágio final do processo em que uma pleurite inflamatória ou infecciosa apresenta uma resposta de cura anormal.46 Suas causas comuns incluem o empiema ou a EPC (ambos indevidamente tratados), cirurgia de revascularização miocárdica, pleurisia reumatoide, efusão pleural tuberculosa e um hemotórax tratado de modo inadequado. Nestes casos, existe uma membrana fibrosa cobrindo uma área de pleura visceral, que previne o pulmão de se expandir até a parede torácica. Até que um novo estado estável seja estabelecido, o aumento da pressão intrapleural negativa conduz à formação de líquido pleural.
Diagnóstico
Clinicamente, os pacientes podem ser assintomáticos se o pulmão encarcerado for pequeno. Entretanto, esses pacientes podem apresentar dispneia (às vezes, durante meses ou anos após a inflamação pleural) se o pulmão encarcerado for grande ou diante da existência de uma doença pulmonar significativa subjacente. Uma radiografia torácica costuma mostrar uma efusão pleural unilateral, de tamanho pequeno a moderado. Pode ou não haver deslocamento ipsilateral do mediastino.
A análise do líquido pleural revela a existência de um transudato seroso com predominância de linfócitos. Contudo, a concentração de proteínas pode tornar-se maior que 3 g/dL, se a toracocentese for realizada antes da resolução completa da resposta inflamatória.47 O pH é maior que 7,45, e os níveis de glicose no líquido pleural equivalem aos níveis séricos. O diagnóstico é sugerido pelos achados da manometria pleural, que mostram a ocorrência de uma queda significativa da pressão pleural (após a remoção de mais de 15 cm de H2O/L de líquido pleural). A retirada de líquido tipicamente está associada a uma dor torácica subesternal.47 A toracocentese resulta em dor torácica subesternal quando a pressão exercida pelo líquido pleural sofre uma queda significativa. A dor torácica pode ser aliviada instantaneamente pela introdução de uma pequena quantidade de ar no espaço pleural, com o objetivo de aumentar a pressão pleural.47 Em seguida à toracocentese, o líquido pleural reaparece de modo relativamente rápido, no decorrer de alguns dias, até atingir o mesmo volume existente antes da toracocentese. O pulmão encarcerado pode ser confirmado por TC, obtida com o lado afetado voltado para cima, demonstrando uma casca pleural visceral.
Tratamento
Se a extensão do pulmão encarcerado for pequena e o paciente for assintomático, o tratamento contribui para restabelecer a confiança do paciente. No caso do paciente sintomático que apresenta pulmão subjacente normal, o tratamento está ligado à decorticação do pulmão encarcerado.
Efusões exsudativas
Efusões parapneumônicas
Uma efusão parapneumônica consiste em um acúmulo de líquido pleural, associado à pneumonia ou a um abscesso pulmonar. Uma efusão parapneumônica sem complicação exibe proporções pequenas a moderadas e é unilateral, sendo resolvida após uma terapia antibiótica isolada e sem resultar em sequelas junto ao espaço pleural. Uma EPC é constituída por líquido pleural unilateral e requer drenagem do espaço pleural para resolução de uma sepse pleural. Um empiema é definido pela presença de pus no espaço pleural, e representa uma EPC no estágio final e sempre requer drenagem.
As efusões parapneumônicas constituem a causa mais comum de uma efusão pleural exsudativa, desenvolvendo-se em 40 a 57% dos pacientes com pneumonia bacteriana.48 Um total de 10 a 15% destes pacientes desenvolve EPC, com progressão para empiema em aproximadamente 5% dos casos.
Diagnóstico
Os pacientes com efusões parapneumônicas apresentam sintomas típicos de pneumonia. Entretanto, é problemático discernir clinicamente, no momento da apresentação (ou seja, baseando-se na dor torácica, febre e contagem de leucócitos sanguíneos), quais pacientes apresentam efusão parapneumônica sem complicação e quais casos são complicados.49
A apresentação clínica do paciente, as imagens torácicas e os achados no líquido pleural são achados que, quando combinados, indicam se o paciente necessitará de drenagem do espaço pleural. Entre as indicações para drenagem inicial estão a existência de uma infecção anaeróbia, sintomas prolongados de pneumonia, falha em responder à terapia antibiótica e virulência do patógeno bacteriano subjacente (p. ex., aeróbios gram-negativos, anaeróbios e Staphylococcus aureus). Na análise do líquido pleural, a presença de pus (isto é, sintoma de empiema) constitui uma indicação absoluta para realização da drenagem. Um resultado positivo de coloração de Gram ou cultura bacteriana, um pH menor do que 7,3 e uma proporção entre níveis de glicose no líquido pleural e níveis de glicose no soro inferior a 0,5, além de níveis de LDH no líquido pleural acima de 1.000 UI/L são também fortes indicações da necessidade de drenagem.
Vários achados fornecidos pelo exame do tórax por meio de radiografias ou TC sugerem a necessidade de uma drenagem imediata. Tais achados incluem: (1) uma efusão pleural que ocupe mais da metade do hemitórax; (2) presença de 1 ou mais níveis de ar-líquido no espaço pleural; (3) existência de 1 ou mais loculações; (4) espessamento pleural acentuado (> 5 mm); e (5) intensificação das membranas pleurais na TC.
Uma efusão parapneumônica sem complicação consiste em um exsudato de fluxo livre, que apresenta predominância de neutrófilos, pH = 7,3, proporção de níveis de glicose no líquido pleural e no soro > 0,5 e níveis de LDH < 700 UI/L. Geralmente estes pacientes requererem somente terapia antibiótica direcionada para a pneumonia, sendo tipicamente desnecessária a escalada da dosagem.
Tratamento
Pacientes com EPC necessitam de terapia antibiótica e drenagem do espaço pleural. A drenagem é realizada utilizando-se um pequeno tubo torácico padrão ou um cateter de pequeno calibre, com ou sem administração de agentes fibrinolíticos.
O First Multicenter Intrapleural Sepsis Trial (MIST1) – um estudo amplo, randomizado e controlado realizado nos Estados Unidos – selecionou ao acaso pacientes que apresentavam efusões parapneumônicas (83% dos quais tinham empiema) para receber estreptoquinase no espaço pleural ou placebo. Decorridos 3 e 12 meses, o estudo não encontrou nenhuma diferença entre estes 2 grupos, em termos de mortalidade ou percentual de pacientes que necessitavam de cirurgia.50 A descorticação e a empiemectomia por toracoscopia ou toracotomia geralmente se fazem necessárias em casos de pacientes com empiema crônico.
Efusão pleural maligna
Depois das efusões parapneumônicas, as efusões malignas constituem a 2ª causa mais comum de formação de exsudato. Os cânceres de pulmão e de mama representam 60% de todas as efusões pleurais malignas, enquanto os linfomas correspondem a cerca de 10% dos casos.51 As efusões pleurais linfomatosas em geral se desenvolvem depois que o diagnóstico de linfoma é estabelecido. Quase todos os carcinomas podem metastatizar para o pulmão e espaço pleural.
Etiologia e patogênese
No câncer de pulmão, as efusões pleurais mais comumente resultam de metástases ipsilaterais, que ocorrem por meio da invasão da artéria pulmonar, seguida de embolização rumo à superfície pleural visceral. A partir deste ponto, o tumor entra no espaço pleural e promove envolvimento subsequente da pleura parietal.52 As metástases contralaterais produzidas no câncer de pulmão surgem após o envolvimento hepático, por meio da disseminação hematógena para a região pulmonar contralateral. No câncer de mama, as metástases pulmonares podem ocorrer através dos linfáticos da parede torácica ou por disseminação hepática. O mecanismo mais comum de desenvolvimento de efusões pleurais no linfoma de Hodgkin é a obstrução linfática, enquanto a invasão pleural direta tende a causar efusões pleurais no linfoma não Hodgkin (LNH). Este linfoma, por sua vez, constitui uma das causas mais comuns de quilotórax. Muitas vezes, as efusões pleurais bilaterais estão associadas ao envolvimento nodal mediastinal, metástases parenquimais bilaterais ou irradiação mediastinal prévia com consequente pericardite constritiva ou fibrose dos linfáticos pleurais mediastinais.
A carcinomatose linfangítica apresenta associação mais frequente com os adenocarcinomas de pulmão, mama, estômago, pâncreas e próstata. Esta condição é radiograficamente caracterizada por adenopatia mediastinal ipsilateral, efusão pleural unilateral e presença das linhas B de Kerley, que apontam a dilatação linfática.
Raramente (isto é, em menos de 5% dos casos), uma efusão maligna pode ser um transudato. Este achado é mais comum em pacientes com diagnóstico duplo (p. ex., um paciente com IC, cujo tecido pleural apresenta disseminação de células malignas). Outras causas de formação de transudato maligno são a obstrução linfática precoce e a obstrução endobronquial com atelectasia resultante.
Diagnóstico
Os sintomas iniciais associados às efusões pleurais malignas são tosse e dispneia ao esforço de manifestação insidiosa, observados em paciente com malignidade comprovada.53 As radiografias podem mostrar uma gama de apresentações associadas a efusões (p. ex., efusões bilaterais ou uma efusão unilateral que pode ser pequena, moderada, ampla ou maciça), em um paciente cujo coração apresenta tamanho normal. Se o paciente exibir uma ampla efusão pleural ipsilateral, na ausência de deslocamento mediastinal contralateral, o diagnóstico mais provável é o de câncer de pulmão com envolvimento metastático do brônquio ipsilateral do tronco principal e atelectasia associada. Quando o paciente apresenta uma ampla efusão pleural unilateral com deslocamento mediastinal contralateral, a causa costuma ser uma lesão primária não pulmonar. A causa mais comum de efusões pleurais bilaterais em pacientes com tamanho normal de coração é um carcinoma não pulmonar acompanhado de metástases pleurais bilaterais.
Na análise do líquido pleural, o líquido consiste em um exsudato de aspecto seroso a sanguinolento, que pode ser discordante nos critérios de proteína ou de DHL. Uma efusão maligna, cuja concentração de amilase esteja elevada e que tenha sido confirmada por análise isoenzimática como tendo isótipo predominantemente salivar, é mais provavelmente causada por um adenocarcinoma pulmonar.27 Cerca de 30% dos pacientes com efusões pleurais malignas exibem pH < 7,3. Um pH < 7,3 sugere um prognóstico mais desfavorável, porque está associado a uma doença em estágio avançado junto ao espaço pleural e a uma resposta diminuída à pleurodese.21 O rendimento da citologia e do exame de biópsia pleural depende do estágio da doença: quanto mais avançado for o estágio da doença, mais alta é a sensibilidade dos procedimentos diagnósticos. No caso da citologia, 45 a 90% dos achados resultam positivos. No exame de biópsia pleural percutânea, 40 a 50% dos resultados são positivos. Por fim, na toracoscopia, 95 a 100% dos resultados são positivos.
Tratamento
O tratamento deve ser individualizado. A toracocentese terapêutica ambulatorial constitui uma alternativa razoável para pacientes com doença em estágio bastante avançado e sobrevida limitada. No caso dos pacientes com encarceramento pulmonar, a instalação de um cateter interno constitui o tratamento de escolha. O cateter pode ser colocado durante um procedimento ambulatorial, e o paciente pode aliviar a dispneia em casa, sempre que necessário, fixando o sistema de drenagem. Para o paciente que apresenta pulmão expansível após a toracocentese terapêutica, a pleurodese química com talcagem ou doxiciclina geralmente é efetiva como método paliativo.
Embolia pulmonar
A incidência de efusões pleurais em paciente com embolia pulmonar é de 40 a 50%. As efusões pleurais podem se desenvolver em pacientes com embolia pulmonar, até mesmo na ausência de um infarto pulmonar.
A isquemia provoca aumento da permeabilidade capilar, que, por sua vez, promove a movimentação do líquido rico em proteínas da embolia pulmonar para dentro do espaço pleural. A atelectasia pode levar à formação de transudato, na ausência de isquemia e de infarto. Em raros casos, um amplo infarto hemorrágico pode levar ao desenvolvimento de hemotórax em paciente tratados com heparina.
Diagnóstico
A presença de uma efusão pleural não altera os sinais e sintomas de embolia pulmonar. Estes sinais e sintomas incluem uma dor torácica pleurítica ipsilateral; manifestação aguda de dispneia; taquipneia; taquicardia com ou sem febre baixa; e hemoptise. A efusão pleural frequentemente é encontrada quando o paciente é admitido no departamento de emergência ou hospital, sendo ipsilateral em relação à dor torácica.54
A radiografia torácica inicial tipicamente revela uma efusão unilateral pequena (ou seja, menos de 1/3 do hemitórax).54 A radiografia do tórax pode mostrar um infarto pulmonar (manifestado em forma de infiltração parenquimal) em aproximadamente metade dos pacientes. O infiltrado parenquimatoso geralmente é observado nos lobos inferiores. Uma efusão com um infarto radiográfico associado tende a ser maior, porém seu volume ainda corresponde a menos de 1/3 do hemitórax.
Em casos de embolia pulmonar, os resultados da análise do líquido pleural são altamente variáveis. Um exsudato é encontrado em 80% dos casos, enquanto um transudato é detectado nos demais 20%.55 O exsudato pode conter um líquido hemorrágico, com predominância de neutrófilos ou células mononucleares. Os níveis de glicose no líquido pleural e no soro são similares, sendo que o pH do líquido pleural é maior que 7,3. O exsudato clássico, que é hemorrágico e predominantemente neutrofílico, é encontrado em apenas 30% dos casos.
A embolia pulmonar pode ser diagnosticada por angiograma de TC. No contexto clínico apropriado, o diagnóstico pode ser sustentado por um resultado positivo ao exame de Doppler de membro inferior. Um resultado negativo neste exame, bem como um resultado negativo no teste do D-dímero, essencialmente excluem o diagnóstico de embolia pulmonar, exceto diante de uma suspeita extremamente alta. Nesta última situação, deve ser obtida uma angiografia por TC.
Tratamento
O tratamento da efusão pleural, no contexto da embolia pulmonar, é a heparina. O uso de anticoagulante não é contraindicado pela existência de uma quantidade mínima de sangue na expectoração ou na efusão. Entretanto, nos casos com envolvimento de grandes volumes de hemoptise ou efusão pleural grosseiramente sanguinolenta (ou seja, acima de 10%), deve-se instalar um filtro na veia cava inferior, e o curso de heparina deve ser interrompido. Uma pequena efusão pleural sem evidências radiográficas de infarto tende a atingir o pico rapidamente (isto é, dentro de 72 horas após o aparecimento) e ser resolvida em 7 a 10 dias. Uma efusão maior, associada a evidências radiográficas de infarto, persiste por mais tempo, geralmente 7 a 21 dias.54
Efusão pleural tuberculosa
A efusão pleural tuberculosa representa a forma mais comum de tuberculose extrapulmonar, correspondendo a cerca de 5% de todas as doenças produzidas por Mycobacterium tuberculosis. A efusão pleural é encontrada em até 10% dos pacientes não tratados que apresentam resultados positivos no teste cutâneo com derivado proteico purificado (PPD – em inglês, purified protein derivative).32
A efusão ocorre quando um foco subpleural de tuberculose ativa se rompe dentro do espaço pleural e inicia uma resposta imunomediada contra a proteína tuberculina. As efusões pleurais tuberculosas são formadas após a fase primária da infecção (aproximadamente, 3 a 6 meses após a exposição). Nos casos de reativação da tuberculose, pode haver formação de efusão pleural a qualquer momento.32
Diagnóstico
Estes pacientes apresentam tosse não produtiva, febre e dor torácica, muitas vezes de origem pleurítica.56 Os sintomas tendem a ser mais graves em pacientes com doença em fase pós-primária do que naqueles com reativação da doença. Os pacientes de idade mais avançada tendem a apresentar reativação da doença.
O teste cutâneo de PPD resulta positivo em 69 a 100% dos pacientes que apresentam efusão pleural tuberculosa. Entretanto, este teste pode apresentar um resultado negativo passageiro, devido à presença das células mononucleares circulantes, que suprimem as células T sensibilizadas no sangue periférico e na pele, mas não no espaço pleural. Quase todos os pacientes que apresentam resultados negativos no teste cutâneo de PPD subsequentemente apresentam resultados positivos quando o teste é repetido depois de 2 meses.56
A radiografia torácica tipicamente revela a presença de uma efusão pleural unilateral (mais comumente no lado direito), de proporções pequenas a moderadas, que é maciça em 10% dos pacientes. As efusões bilaterais são encontradas em 10% dos pacientes HIV-positivos e em 5% dos pacientes HIV-negativos. A doença parenquimatosa pode ser observada por radiografia torácica em cerca de 33% dos pacientes,57 sendo observada por TC em aproximadamente 75% dos pacientes. A doença parenquimatosa é menos comumente encontrada na doença pós-primária. As efusões podem apresentar loculação em até 30% dos casos.
O líquido pleural consiste em um exsudato clássico e é tipicamente seroso; é serossanguinolento em 10% dos casos, mas nunca é francamente sanguinolento.32 Os níveis totais de proteína no líquido pleural quase sempre ultrapassam 4 g/dL; estão acima de 5 g/dL em cerca de 75% dos pacientes. A contagem de células nucleadas em geral varia de 2.000 a 8.000/mcL e, classicamente, apresenta 90 a 95% de linfócitos. Os pacientes apresentam predominância de neutrófilos durante a fase aguda da doença. Em indivíduos com ELP (isto é, contagem de eosinófilos > 10%) ou cujas contagens de células nucleadas apresentem mais de 5% de células mesoteliais, a tuberculose constitui um diagnóstico bastante improvável. Em 20% dos pacientes, os níveis de glicose estão abaixo de 60 mg/dL e o pH é inferior a 7,3. Em 80% dos pacientes, o líquido pleural tem pH abaixo de 7,4 e concentração de glicose frequentemente entre 60 e 100 mg/dL.
Os achados histológicos encontrados no tecido pleural, bem como os resultados da cultura de tecido pleural, líquido pleural e escarro estabelecem o diagnóstico em até 85% dos casos. Níveis de ADA elevados no líquido pleural (40 a 60 UI/L) sustentam o diagnóstico de efusão pleural tuberculosa, desde que a artrite reumatoide e o empiema sejam clinicamente improváveis.31 Níveis de ADA abaixo de 40 UI/L apresentam alto valor preditivo negativo para tuberculose.
Tratamento
O tratamento usual da tuberculose pleural consiste na terapia combinada com isoniazida, rifampina, pirazinamida e etambutol Com o tratamento, os pacientes em geral se tornam afebris em 2 semanas. A efusão pleural tipicamente é resolvida em 4 a 6 semanas, com ou sem tratamento, embora possa persistir por até 16 semanas. Sem tratamento, a tuberculose pulmonar ou extrapulmonar apresenta uma taxa de recorrência de até 65% dentro de um período de 5 anos.60 Pode haver espessamento pleural residual em 50% dos pacientes. Devido à alta taxa de recorrência entre os pacientes não tratados, devem ser tratados todos os pacientes que apresentam exsudato predominantemente linfocítico não diagnosticado e positividade no teste cutâneo de PPD. A terapia à base de corticosteroides é efetiva para a resolução dos sintomas severos e a promoção de uma resolução mais rápida da efusão pleural. Contudo, esta terapia não afeta o espessamento pleural residual.
Pleurisia reumatoide
As efusões pleurais são encontradas em cerca de 5% dos pacientes com artrite reumatoide. Na autópsia, aproximadamente 50% dos pacientes com doença reumatoide apresentam fibrose e efusão pleurais. A incidência da pleurisia reumatoide possui forte predominância masculina (4:1), sendo que a condição tipicamente se manifesta em homens durante a 6ª década da vida. As efusões pleurais desenvolvem-se em pacientes com nódulos reumatoides, níveis séricos elevados de fator reumatoide e artrite de grau moderado a severo, dentro de 5 a 10 anos após o aparecimento da doença articular. Entretanto, há relatos de efusões que surgiram com 3 anos de antecedência em relação à manifestação da doença articular, bem como após 20 anos.
Acredita-se que as efusões pleurais sejam produzidas pela inflamação pleural local, mediada por imunocomplexos. As efusões reumatoides crônicas resultam do aprisionamento do pulmão. Pequenas placas fibrosas, nódulos reumatoides ou fibrose extensiva envolvem a pleura visceral.
A esfoliação celular a partir dos nódulos reumatoides pleurais viscerais produz um líquido pleural que parece estar cheio de debris. Um espessamento pleural marcante inibe o influxo de glicose e o efluxo dos íons de hidrogênio, com consequente diminuição dos níveis de glicose e pH.
Diagnóstico
Os pacientes podem apresentar dor torácica pleurítica e dispneia; geralmente, são afebris, mas também podem ser assintomáticos.61 É comum uma radiografia torácica mostrar a presença de uma efusão unilateral, de proporções pequenas a moderadas, em geral sem outras manifestações de doença pulmonar reumatoide. Em 1/3 dos pacientes, contudo, observa-se uma manifestação adicional de doença pulmonar reumatoide (isto é, nódulos ou doença intersticial).62
Na análise, o líquido pleural exibe um aspecto grosseiro e variável. Estas efusões podem ser serosas, ter cor amarelo-esverdeada, ser turvas, leitosas (p. ex., na efusão de colesterol), hemorrágicas ou repletas de debris.63 As contagens de células nucleadas variam de 100 a 15.000/mcL. Em muitos casos, as efusões contendo menos de 100 células/mcL são produzidas por um pulmão aprisionado. Neutrófilos ou células mononucleares podem estar presentes, dependendo de quando a toracocentese é realizada, em relação à lesão pleural aguda. As efusões reumatoides apresentam a tríade clássica de níveis de glicose abaixo de 30 mg/dL, pH igual a 7 e níveis de DHL acima de 1.000 UI/L.64 Uma diminuição dos níveis de complemento, aumentos marcantes dos níveis de imunocomplexos e títulos de fator reumatoide acima de 1:320 são achados típicos de pacientes com pleurisia reumatoide. Em termos de citologia, o líquido pleural exibe o aspecto exclusivo de células alongadas em forma de girino ou de cometa, circundando material necrótico eosinofílico, granular.65
O diagnóstico provável é deduzido com base nos achados da tríade característica do líquido pleural. O diagnóstico é confirmado pelo aspecto citológico clássico do líquido pleural [Figura 1].
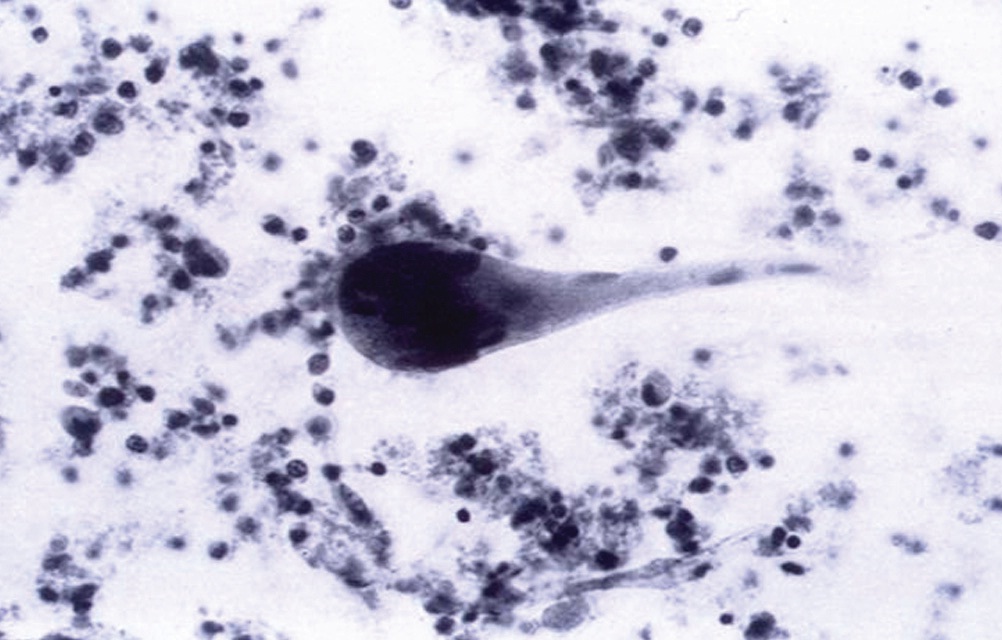
Figura 1. Fotomicrografia do líquido pleural de um paciente do sexo masculino, com 55 anos de idade, que tinha doença reumatoide ativa. Na pleurisia reumatoide, observa-se caracteristicamente um material necrótico granular de fundo e a presença de células alongadas em forma de girino ou cometa, que representam a exfoliação dos nódulos reumatoides pleurais viscerais.
Tratamento
Os corticosteroides e fármacos anti-inflamatórios não hormonais têm sido empregados no tratamento das efusões pleurais reumatoides. Entretanto, foram realizados estudos não controlados para avaliar a utilidade destes agentes. Foram relatadas respostas pouco confiáveis aos corticosteroides. O curso da doença é variável. É incomum haver resolução da efusão pleural reumatoide em menos de 3 a 4 semanas, sendo que este tipo de efusão caracteristicamente se resolve em 4 a 6 meses. Alguns pacientes podem apresentar um espessamento pleural progressivo, que eventualmente pode resultar em um pulmão encarcerado. O encarceramento do pulmão pode ser tratado de forma bem-sucedida por meio de decorticação, anos após o aparecimento da pleurisia, contanto que o pulmão subjacente esteja normal.
Efusões pleurais de origem extravascular (EPOEV)
As efusões pleurais de origem extravascular (EPOEV) podem ser transudatos ou exsudatos.66 Como as EPOEV tendem a ser incomuns, o clínico muitas vezes desconsidera estas entidades ao se deparar com uma efusão pleural problemática [Tabela 11].
Tabela 11. Análise do líquido pleural:EPOEV66
|
Diagnóstico |
Aspecto |
Proteínas totais (g/dL) |
DHL (UI/L) ou proporção* |
Células nucleadas/mcL |
Glicose (mg/dL) |
pH |
Exame diagnóstico |
|
Transudatos |
|
|
|
|
|
|
|
|
Diálise peritoneal |
Cor amarela |
< 1, faixa de 0,07 a 0 |
6 a 55 |
1 a 100 mononuclear |
200 a 2.030 |
NR |
PT < 1 e proporção LP:S de glicose > 2; sinal da linha negra |
|
Urinotórax |
Amarelo-claro |
< 1, faixa de 0,1 a 1,6 |
< 0,3 |
23 a 1.500 mononuclear |
LP = S |
6,8 a 8 |
Proporção LP:S de creatinina > 1; faixa de 1,01 a 15,7 |
|
Fístula duropleural (não traumática) |
Aquosa |
< 1, faixa de 0,2 a 0,8 |
56 a 97 |
30 a 150 mononuclear |
Proporção LCE:LP < 1 e > 0,5 |
7,55 |
Presença de beta-2-transferrina |
|
Exsudatos |
|
|
|
|
|
|
|
|
Shunt ventriculopleural |
Sanguinolento Aquoso |
Exsudato |
Exudato |
PMN |
Variável |
> 7,45 |
Hematócrito LP/S e > 0,5 presença de beta-2-transferrina |
|
Glicinotórax |
Cor de sangue e límpido |
< 1 |
Baixa |
Mononuclear |
Proporção LCE:LP |
7,55 |
Alta proporção LP:S de glicina |
|
0,2 |
NR |
NR |
NR |
NR |
| ||
|
Quilotórax |
Leitoso, turvo, límpido, hemorrágico |
2,1 a 7,1 |
< 268 |
400 a 6.800; > 80% linfócitos |
48 a 200, proporção LP:S < 1 |
7,4 a 7,8 |
TG > 110 mg/dL; presença de quilomícrons |
|
Fístula pancreatopleural |
Límpida a turva amarelada |
4,5 |
> 1.000 |
Predominância de PMN |
P = S |
7,3 a 7,35 |
Amilase > 100.000 UI/L |
|
Ruptura esofágica |
|
|
|
|
|
|
|
|
Com pleura mediastinal intacta |
Serosa ou turva |
> 3 |
Proporção LP:S > 0,82 |
50 a 25.000, com predominância de PMN |
P = S |
> 7,3 |
Nenhum |
|
Com ruptura da pleura mediastinal |
Purulenta |
> 3 |
> 1.000 |
200 a 100.000, com predominância de PMN |
0 < 60 |
< 7 |
Amilase salivar aumentada (200 a 1.922 UI/L); pH 6 a 7; citologia do LP: partículas de alimento; células epiteliais escamosas |
|
Fístula biliopleural |
Esverdeada |
Exudato |
Exudato |
Predominância de PMN |
P = S |
> 7,3 |
Proporção LP:S de bilirrubina > 1 |
|
Fístula gastropleural |
Turva |
Exudato |
Exudato: DHL pode ser >100 |
Predominância de PMN variável |
P = S |
Pode ser > 7,3 |
Radiografias, endoscopia; citologia do LP: partículas de alimento; células epiteliais escamosas |
|
Transudato ou exsudato | |||||||
|
Migração extravascular de CVC |
NPT/lípidio: leitoso |
< 1 |
NR |
Variável |
LP > S |
> 7,45 |
TG > 110 mg/dL |
|
|
Glicose/salina: límpido |
< 1 |
37 a 98 |
Variável |
LP > S |
> 7,45 |
Proporção LP:S de glucose > 1; PT < 1 |
*Níveis de lactato desidrogenase (DHL) no LP > 67% do limite máximo de valores séricos normais.
CVC = cateter venoso central; EPOEV = efusões pleurais de origem extravascular; LCE = líquido cerebrospinal; LP = líquido pleural; LP:S = líquido pleural:soro; NPT = nutrição parenteral total; NR = não relatado; P = S = níveis no líquido pleural equivalentes aos níveis séricos; PMN = leucócito polimorfonuclear; PT = proteínas totais; S = soro; TG = triglicerídeos.
Transudatos EPOEV
Hidrotórax causado pela diálise peritoneal ambulatorial contínua (DPAC)
Os pacientes submetidos à diálise peritoneal prolongada (como a diálise peritoneal ambulatorial contínua [DPAC]) apresentam risco de desenvolvimento de efusão pleural. Mais de 70 casos de efusão pleural decorrente de diálise peritoneal foram relatados no início da década de 1990. Entretanto, a verdadeira incidência desta complicação é desconhecida. Com base nos dados fornecidos por 161 centros, a efusão pleural desenvolve-se em 1,6% dos pacientes submetidos à DPAC. Há relatos da ocorrência de efusão pleural em 1 dia a 8 anos após o início da diálise.67 Os fatores de risco para desenvolvimento das efusões pleurais incluem a multiparidade e a peritonite.
A infusão do dialisado peritoneal causa aumento da pressão intrabdominal. É provável que o líquido peritoneal se desloque para dentro do espaço pleural através de defeitos existentes no diafragma, que se tornam patentes com o aumento da pressão peritoneal resultante do dialisado infundido.
As consequências de uma efusão pleural para os pacientes submetidos à dialise peritoneal incluem o desenvolvimento de hidrotórax hipertensivo, insuficiência respiratória, falência da ultrafiltração e interrupção temporária ou permanente da diálise peritoneal. A retirada do paciente da diálise peritoneal resulta na resolução da efusão pleural.
Diagnóstico. Os pacientes submetidos à diálise peritoneal e que desenvolvem uma efusão pleural podem ser assintomáticos. Nestes casos, a efusão pode ser descoberta por meio de uma radiografia torácica de rotina. Outros pacientes podem se queixar de dispneia, seja ao esforço ou em repouso. Há, ainda, casos de pacientes apresentando insuficiência respiratória aguda,68 em que o diagnóstico pode ser atrasado porque a falta de ar do paciente pode ser inicialmente confundida com uma sobrecarga de volume. Nestes casos, a intensificação da distribuição de diálise hipertônica para corrigir a sobrecarga de volume suspeita pode provocar o aumento da efusão pleural.
A radiografia torácica típica revela a presença de uma efusão pleural à direita, de pequenas proporções e sem outras anomalias. As efusões também podem se formar bilateralmente. Uma efusão pleural maciça, que quase sempre ocorre do lado direito, apresenta predominância feminina.
Na análise, o líquido pleural é descrito como um líquido de cor amarelada, cujo conteúdo total de proteínas é consistentemente inferior a 1 g/dL (variando de 0,07 a 0,5). Os níveis de glicose variam de 200 a 2.000 mg/dL, enquanto o pH não é relatado.68 Os níveis de DHL podem variar de 6 a 55 UI/L. O líquido pleural dos pacientes submetidos à diálise é escasso em células mononucleares (menos de 100/mcL). O diagnóstico pode ser confirmado pelo achado de uma concentração proteica total abaixo de 1 g/dL e níveis de glicose que podem variar de muitas centenas a mais de 1.000 mg/dL. A única causa em potencial destes achados é a migração extravascular do CVC de infusão da glicose.
Em pacientes submetidos à diálise com icodextrina, o diagnóstico pode ser confirmado pela observação do sinal da linha negra da icodextrina (uma alteração de cor característica, resultante da adição de povidona-iodo ao aspirado pleural e de sua interação com a amilase ou amilopectina). A icodextrina, um polímero da glicose, é utilizada por pacientes de diálise para correção da falência da ultrafiltração causada pelo intenso transporte peritoneal. Como a icodextrina apresenta similaridades com o amido, a adição de iodo a um líquido pleural contendo icodextrina produz uma mudança de cor para azul-negra. Este sinal evidencia a ocorrência de vazamento do dialisado para dentro do espaço pleural. Em casos de pacientes que recebem icodextrina, recomenda-se solicitar ao laboratório que adicione povidona-iodo ao aspirado pleural, com o objetivo de confirmar ou excluir a possibilidade de vazamento peritoneal.69
O diagnóstico de efusão pleural também pode ser confirmado pela instilação de coloide de enxofre marcado com tecnécio-99m (99mTc) no interior da cavidade peritoneal, por peritoneocintilografia. A passagem do radioisótopo para dentro do espaço pleural em algumas horas evidencia a existência de uma comunicação peritoneopleural.
Tratamento. Os pacientes que desenvolvem um hidrotórax agudo maciço, de lado direito, precisam de uma toracocentese imediata para aliviar a dispneia. A diálise peritoneal deve ser interrompida. Os pacientes que desenvolvem hidrotórax durante a diálise peritoneal quase sempre precisam mudar para a hemodiálise.
Os pacientes que apresentam efusões menores e assintomáticas podem apresentar fechamento espontâneo do defeito diafragmático após a suspensão da diálise peritoneal. Contudo, a maioria dos pacientes requer algum tipo de terapia que promova o fechamento deste defeito.
Urinotórax
Um urinotórax, que consiste em uma coleção de urina dentro do espaço pleural, resulta de uma uropatia obstrutiva.70 Um urinotórax é um distúrbio raro. As causas relatadas incluem os cânceres de bexiga e próstata, nefrolitíase, manipulação cirúrgica ureteral e trauma cego renal. Existem 2 relatos de casos de urinotórax durante a gestação. Em um estudo envolvendo 375 pacientes submetidos à nefrolitotomia percutânea supracostal, 4 pacientes (1%) desenvolveram urinotórax.71
A uropatia obstrutiva leva ao acúmulo de líquido perirrenal e ao desenvolvimento de um urinoma (ou seja, uma coleção retroperitoneal de líquido). Conforme grandes quantidades de urina entram no mediastino, o urinoma retroperitoneal se rompe dentro do espaço pleural. Como alternativa, a urina pode vazar via retroperitônio para dentro do espaço pleural, passando por hiatos ou defeitos existentes no diafragma. O urinotórax tipicamente é ipsilateral em relação ao rim obstrutivo, embora existam relatos de casos raros de envolvimento contralateral.70 O urinotórax geralmente se desenvolve com relativa rapidez, uma vez que a obstrução seja severa o bastante para causar um urinoma retroperitoneal. De modo similar, o urinotórax é resolvido de forma relativamente rápida, tão logo a obstrução tenha sido removida.70
Diagnóstico. A suspeita de urinotórax pode ser considerada no caso de um paciente que tenha desenvolvido dispneia após um traumatismo ou manipulação ureteral.70 Um urinotórax pequeno e assintomático pode ser encontrado durante uma radiografia torácica de rotina. O intervalo decorrido entre o evento precipitante e o aparecimento do urinotórax varia de 8 horas a 2 meses. Entretanto, a maioria dos casos é diagnosticada dentro de 48 horas.70
A radiografia torácica em geral mostra a presença de uma efusão pleural de tamanho pequeno a moderado, em localização ipsilateral em relação ao rim obstruído. Contudo, casos de efusões bi e contralaterais também foram descritos. Tipicamente, a radiografia não mostra nenhuma outra anormalidade.
A análise do líquido pleural revela um líquido límpido e de cor amarela. O conteúdo total de proteínas geralmente é menor que 1 g/dL, mas pode ultrapassar este valor em pacientes que sofreram traumatismo, se uma hemorragia estiver contribuindo para a formação da efusão. O diagnóstico é estabelecido pela detecção de níveis de creatinina no líquido pleural acima dos níveis concomitantemente encontrados no soro.70,72 A diferença relatada entre os níveis de creatinina no líquido e no soro varia de 1,08 a 15,7. Os níveis de glicose no líquido pleural são semelhantes aos níveis de glicose no sangue. O pH pode ser baixo (< 7,3), normal (7,3 a 7,55) ou alcalino (aproximando-se de 8), dependendo do pH da urina extravasada. Um urinotórax é a única causa de efusão pleural transudativa com pH baixo.19
Tratamento. O tratamento do urinotórax envolve o alívio da uropatia obstrutiva. O urinotórax é resolvido em algumas horas a poucos dias, depois que a obstrução é aliviada. O aumento da proporção entre níveis de creatinina no líquido pleural e no soro também tende a ser rapidamente revertido.70,72 Devido à rápida resolução de um urinotórax, o momento em que a toracocentese é realizada é decisivo para estabelecer o diagnóstico definitivo. Um urinotórax não deixa sequelas junto ao espaço pleural.
Fístula duropleural
A fístula duropleural, ou fístula subaracnóidea-pleural, representa uma comunicação entre os espaços subaracnoide e pleural. A fístula duropleural é um distúrbio raro – existem apenas 30 casos descritos na literatura de língua inglesa. Entretanto, é possível que a fístula duropleural seja sub-relatada, por ser uma complicação relativamente comum da cirurgia de medula espinhal, sendo rotineiramente reparada sem ser relatada pelos neurocirurgiões. A maioria dos casos de fístula duropleural é secundário a um trauma fechado ou penetrante.73
Uma fístula duropleural resulta do rompimento das membranas dural e parietal pleural. A partir deste rompimento, desenvolve-se uma trajetória entre os espaços subaracnoide e pleural. Um gradiente de pressão causa o deslocamento do líquido do espaço subaracnoide (pressão positiva) para o espaço pleural (pressão negativa). Este gradiente de pressão mantém a fístula duropleural aberta.
Diagnóstico. É preciso haver um alto índice de suspeita clínica para estabelecer o diagnóstico de fístula duropleural. Os sintomas sugestivos de um vazamento de líquido cerebrospinal (LCE) incluem dores de cabeça posturais, náusea e vômitos. Os sintomas frequentemente relacionados à efusão (p. ex., dor torácica, dispneia e febre) podem ser mínimos ou podem ser obscurecidos por lesões concomitantes, resultando, muitas vezes, em atraso do diagnóstico.73
A radiografia inicialmente obtida após o traumatismo pode resultar normal, porque muitas vezes a formação da efusão demora vários dias. As efusões pleurais variam de pequenas a maciças, dependendo do tamanho e duração da presença da fístula. Uma alargamento mediastinal também pode ser observado. Em um paciente que sofreu traumatismo e desenvolveu efusão pleural, o diagnóstico de fístula duropleural deve ser considerado mediante exclusão da possibilidade de lesão aórtica.
Em casos de pacientes com fístula duropleural não traumática, o líquido pleural é límpido e aquoso.74 A contagem de células nucleadas é baixa. A concentração de glicose é menor do que no soro, porém a proporção entre glicose no líquido pleural e glicose no soro não é inferior a 0,5.73,74 Os aspectos importantes desta efusão transudativa são o nível proteico total consistentemente abaixo de 1 g/dL e o nível de DHL nitidamente dentro da faixa transudativa.74 Mesmo assim, existem relatos de casos de fístula duropleural em que o líquido pleural é um exsudato. Muitos destes casos estão associados a um trauma envolvendo hemorragia do espaço pleural ou pneumonia pós-operatória.73 Nestes cenários, a análise do líquido pleural pode ser inconclusiva. Para estabelecer o diagnóstico de fístula duropleural, o líquido pleural pode ser testado quanto à presença de beta-2-transferrina, que é um marcador sensível e específico para identificação de vazamentos de LCE para dentro do espaço pleural após uma lesão na cabeça, traumatismo na coluna espinhal ou cirurgia espinal. A beta-2-transferrina é produzida pela ação da neuraminidase sobre o tecido cerebral. O único local adicional em que esta proteína é encontrada é a perilinfa da orelha interna.75 A quantificação de beta-2-transferrina é disponibilizada para o clínicos da prática na maioria dos laboratórios.
Embora a presença de beta-2-transferrina no líquido pleural estabeleça o diagnóstico de fístula duropleural, a identificação definitiva da fístula requer visualização radiográfica. As mielografias convencional e com radionuclídeo são as técnicas mais comumente utilizadas. Contudo, há relatos de resultados falso-negativos com o uso apenas da mielografia, em casos nos quais o vazamento de LCE é lento ou intermitente. Por isso, a realização de uma TC concomitante à obtenção da mielografia ajuda a delinear o defeito anatômico. Além disso, a existência de contraste no espaço pleural após a obtenção da mielografia confirma o diagnóstico em casos de pacientes com vazamentos lentos de LCE.
Tratamento. Não há um consenso forte quanto ao tratamento da fístula duropleural. A resolução espontânea é rara, e a maioria dos pacientes necessita de drenagem com tubo fechado, ligação cirúrgica ou ambas para que a efusão seja resolvida e a fístula, fechada. O momento apropriado para a intervenção cirúrgica está aberto à discussão. Alguns cirurgiões defendem a instituição de uma drenagem via tubo torácico por até 2 semanas, antes da intervenção cirúrgica, enquanto outros recomendam a realização da intervenção sem demora, considerando o baixo índice de fechamentos espontâneos.
Exsudatos EPOEV
Quilotórax
O quilotórax, que é uma causa relativamente rara de efusão pleural, está mais comumente associado a malignidades, em particular ao LNH. A formação do quilotórax pode ser secundária à cirurgia e 2 de suas causas cirúrgicas mais frequentes são a cirurgia cardiotorácica com esofagectomia e a cirurgia para doença cardíaca congênita. O traumatismo, incluindo uma hiperextensão inócua da espinha torácica, também está implicado. A linfangioleiomiomatose (LAM) também pode produzir quilotórax. Cerca de 25% dos pacientes com LAM desenvolvem quilotórax durante o curso da doença, enquanto 9% dos pacientes apresentam quilotórax na manifestação da doença. Cirrose, linfadenopatia tuberculosa, qualquer forma de linfangiectasia e trombose na veia subclávia esquerda são todas condições implicadas como causas.
Quando o ducto torácico ou um de seus ramos tributários é rompido, o quilo corre para os tecidos adjacentes. Quando a pleura mediastínica permanece intacta, há formação de um quiloma após vários dias. Conforme mais quilo vai escapando para dentro do mediastino, o quiloma se rompe no interior do espaço pleural. A localização precisa da ruptura no ducto torácico determina se o quilotórax se formará do lado esquerdo ou à direita. O ducto torácico parte da cisterna do quilo (ao nível da 1ª e 2ª vértebras lombares), passa através do hiato aórtico do diafragma (ao nível da 10ª à 12ª vértebras torácicas) e segue à direita da aorta. Ao nível da 5ª e 6ª vértebras torácicas, o ducto torácico entra à esquerda, posteriormente ao mediastino, e une-se à circulação venosa, no ponto de conversão das veias subclávia esquerda e jugular interna. Desta forma, a ruptura do ducto torácico abaixo de T5-T6 causa formação de quilotórax à direita, enquanto a lesão ao ducto acima deste nível resulta na formação de um quilotórax à esquerda ou de quilotórax bilaterais.
Os pacientes com quilotórax podem apresentar dispneia de manifestação aguda ou subaguda. Como o quilo não induz uma resposta inflamatória, a febre ou a dor torácica são atípicas. De maneira similar, como o quilo é bacteriostático, é raro haver empiema. A quiloptise, ou expectoração de quilo, é igualmente rara.76 Foi relatado que as concentrações de TG no escarro variam de 662 a 2.608 mg/dL acima dos valores séricos concomitantes. Também foi descrita a presença de quilomícrons no escarro.76
A análise do líquido pleural tipicamente revela um líquido branco e opalescente, em presença de gordura. Contudo, o líquido pode ser seroso em indivíduos adultos que não tenham se alimentado por 12 horas, ou hemorrágico no contexto de um traumatismo. As células primárias encontradas no quilo são células T, que costumam representar mais de 80% das células nucleadas. A contagem total de células nucleadas varia de 400 a 6.800/mcL.77 Um quilotórax é em geral um exsudato discordante, com níveis proteicos na faixa de exsudato e níveis de DHL na faixa de transudato (pois é uma efusão não inflamatória). Se o conteúdo de TG do líquido pleural for maior que 110 mg/dL, existe uma alta probabilidade de que o paciente tenha quilotórax.28 Ao contrário, se os níveis de TG forem inferiores a 50 mg/dL, é altamente improvável que exista um quilotórax.28 Diante de valores entre 50 e 110 mg/dL, torna-se necessário avaliar a possível presença de quilomícrons. Se estes forem encontrados, o diagnóstico de quilotórax é estabelecido. O pH do líquido quiloso varia de 7,4 a 7,8, e a concentração glicose é equivalente à concentração sérica. A proporção entre os níveis de glicose no líquido pleural e no soro é útil para diferenciar uma efusão quilosa (ou seja, uma proporção igual a aproximadamente 1) da presença de líquido pleural atribuída à migração extravascular de um CVC que esteja distribuindo nutrição parenteral contendo glicose dentro do espaço pleural (isto é, com uma proporção substancialmente maior que 1).78
Tratamento. Não existem estudos prospectivos que orientem o tratamento. Entretanto, 2 princípios importantes devem ser seguidos: (1) os pacientes devem receber drenagem e nutrição adequadas; e (2) a drenagem prolongada deve ser evitada. Os pacientes sintomáticos devem ser tratados com um plano composto por etapas, começando pela drenagem do espaço pleural e pelo suporte nutricional. Se a drenagem não proporcionar a resolução da efusão, deve-se tentar a sínfise pleural, conforme a necessidade. A drenagem prolongada de um quilotórax deve ser evitada, com o objetivo de prevenir o desenvolvimento de imunossupressão e desnutrição. Um quilotórax traumático é tipicamente tratado utilizando-se um tubo de drenagem torácica e nutrição parenteral, a fim de minimizar o fluxo de quilo. Como a maioria dos quilotórax traumáticos é resolvida em 10 a 14 dias, a perda proteica e a imunossupressão em geral são mínimas. Se houver necessidade de se realizar drenagem após 2 semanas de terapia, se a drenagem exceder 1.500 mL durante 5 dias ou se o paciente sofrer uma perda de peso significativa devido à perda progressiva de proteínas, a intervenção cirúrgica passa a ser indicada. O reparo do defeito é a ação ideal, embora haja casos nos quais não é possível identificar precisamente o vazamento. A ligação do ducto torácico, tipicamente logo acima da lateral direita do diafragma, pode ser realizada em alguns pacientes para conter o vazamento de quilo.
Existem relatos recentes de cateterização percutânea e embolização do ducto torácico em pacientes com quilotórax traumático subsequente à realização de procedimentos cirúrgicos.79 Há relatos implicando a somatostatina e a octreotida (um análogo da somatostatina) na diminuição da produção de quilo observada no quilotórax pós-operatório, em estudos realizados com animais e em pequenas séries de casos.80
Fístula pancreaticopleural
Os pacientes com pancreatite aguda podem desenvolver uma efusão pleural (incidência de 3 a 17%) pequena, autolimitada e de lado esquerdo, que é resolvida de modo relativamente rápido tão logo a pancreatite seja resolvida. Em contraste, os casos de pacientes com pancreatite crônica que podem desenvolver efusões pleurais a partir de uma fístula pancreatopleural são menos comuns, crônicos e tipicamente recorrentes. As fístulas pancreatopleurais são mais frequentes em pacientes que sofrem de alcoolismo crônico e apresentam sintomas predominantemente pulmonares, em vez de abdominais. Estas fístulas também podem ocorrer em pacientes sem história prévia de doença pancreática.81 Neste contexto, o diagnóstico da fístula pancreatopleural muitas vezes não é considerado como causa deste tipo de efusão pleural crônica.
Um pseudocisto pancreático, que consiste em um acúmulo de líquido e debris localizado junto ou justaposto ao pâncreas, desenvolve-se em cerca de 10% dos pacientes com pancreatite aguda.81 Apenas metade dos pacientes que possuem um pseudocisto desenvolvem efusões pleurais. Quando uma ampla efusão pleural se forma no contexto da doença pancreática, é mais provável que seja resultante de uma fístula pancreatopleural. A trajetória fistular pode seguir do pâncreas para o mediastino, ambos os espaços pleurais ou até o saco pericárdico.
Diagnóstico. O paciente geralmente apresenta uma história de pancreatite alcoólica. No momento da apresentação, as queixas comuns são dispneia e desconforto torácico. A dor abdominal constitui um sintoma menos frequente.82 A ausência de sintomas abdominais pode ser atribuível à descompressão do pseudocisto pela fístula pancreatopleural.
A radiografia torácica tipicamente mostra a presença de uma efusão pleural ampla a maciça, com deslocamento contralateral mediastinal. Como alternativa, a efusão pode ocorrer no lado direito ou bilateralmente. Na maioria dos casos, nenhuma outra anomalia é observada na radiografia torácica. Entretanto, a análise das radiografias abdominais com frequência permite observar a existência de calcificações no pâncreas.82 O diagnóstico de fístula pancreatopleural deve ser considerado em casos de pacientes que parecem estar cronicamente doentes, têm história de distúrbio pancreático ou traumatismo abdominal e apresentam uma efusão pleural isolada, ampla e à esquerda.
O líquido pleural consiste em um exsudato com predominância neutrofílica e uma concentração extremamente alta de amilase (em geral, acima de 100.000 UI/L). Os níveis de amilase contrastam acentuadamente com os níveis menores detectados em efusões pleurais ricas em amilase e decorrentes de outras causas, tais como pancreatite aguda, malignidade e ruptura esofágica.26 O pH das efusões pancreatopleurais varia tipicamente entre 7,32 e 7,5,18 enquanto a concentração de glicose é similar à concentração de glicose no soro.
Tratamento. O tratamento conservador à base de toracocentese terapêutica e nutrição parenteral total (NPT) é efetivo para cerca de metade dos pacientes. Esta abordagem não cirúrgica tenta minimizar a secreção de enzimas pancreáticas e diminuir o volume de líquido contido no pseudocisto, possibilitando o eventual fechamento da trajetória fistulosa. Em alguns pacientes, a somatostatina ou seu análogo podem promover o fechamento espontâneo da fístula.83 Se uma terapia conservadora com duração de 2 a 3 semanas for inefetiva, a correção cirúrgica da doença pancreática subjacente passa a ser indicada para prevenir recidivas e evitar complicações. A correção cirúrgica inclui a descompressão ductal e a drenagem ou excisão do pseudocisto. A maioria dos pacientes responde bem à cirurgia, e a mortalidade é baixa.84 A drenagem percutânea, que é uma alternativa à cirurgia, está associada a um índice de sucesso aproximado de 75%.85
Perfuração esofágica
Existem 3 causas de perfuração esofágica: traumática (iatrogênica e barogênica), inflamatória e neoplásica.86 A causa iatrogênica é o tipo de causa mais comum de perfuração esofágica, sendo que a dilatação esofágica constitui o procedimento que mais frequentemente resulta em perfuração do esôfago.87 As causas iatrogênicas menos comuns incluem a perfuração pós-cirurgia torácica e as rupturas traumáticas produzidas por tubos esofágicos. A ruptura espontânea do esôfago (cuja denominação mais apropriada é ruptura barogênica, sendo também referida como síndrome de Boerhaave) é relativamente rara. O alcoolismo associado a vômito intenso frequentemente é responsável pela ruptura barogênica. O desenvolvimento secundário de mediastinite e sepse contribuem para a morbidade e mortalidade altas.88
Na síndrome de Boerhaave, a ruptura esofágica quase sempre ocorre na direção longitudinal, junto à metade inferior do esôfago. A porção inferior do esôfago é considerada mais suscetível a rupturas, por ser constituída por musculatura lisa sem sustentação, enquanto a porção superior do esôfago conta com o apoio de uma combinação de fibras de músculo estriado e de músculo liso.89 A velocidade da elevação da pressão esofágica é mais importante na patofisiologia da ruptura do que a pressão de pico exercida sobre a musculatura esofágica. A ingesta de bebidas alcoólicas contribui para o desenvolvimento de esofagite aguda e diminuição da coordenação muscular do esôfago. Conforme a descoordenação muscular aumenta, o esôfago é desviado para a esquerda no interior do hiato esofágico, enquanto a parede lateral esquerda entra em contato direto com a pleura mediastinal, explicando a predominância das efusões pleurais de lado esquerdo.
A manifestação mais dramática da ruptura esofágica está associada à perfuração barogênica. O paciente típico é um homem, na 4ª à 6ª década de vida, que apresenta história de alcoolismo, indiscrição dietética e desnutrição. O paciente caracteristicamente apresenta uma dor epigástrica severa, de natureza pleurítica, podendo ser diagnosticado de forma incorreta como tendo infarto do miocárdio, pancreatite aguda, úlcera péptica perfurada ou empiema de vesícula biliar.86 A dor epigástrica, que é persistente e severa, ocorre após episódios severos de vômito ou ânsia de vômito. O espasmo reflexo da musculatura abdominal superior pode direcionar a atenção do clínico para um processo abdominal primário. A febre, que acomete quase todos os pacientes, é subsequente ao aparecimento da dor torácica. A disfagia ocorre em casos raros, porém o pneumomediastino é um aspecto constantemente observado. Após a perfuração esofágica para o mediastino, um atrito ruidoso sincrônico com o ciclo cardíaco pode ser ouvido no lado esquerdo do coração.
A presença ou ausência de achados radiográficos depende do intervalo decorrido entre a perfuração e a obtenção das radiografias iniciais, sítio de perfuração e integridade da pleura parietal mediastinal.90 Quando a radiografia torácica é obtida em questão de minutos após a perfuração esofágica, geralmente resulta normal e, assim, não exclui o diagnóstico. Um achado de alargamento mediastinal e de níveis hidroaéreos aponta a ocorrência de infecção mediastinal. Estes achados podem ser radiograficamente evidentes decorridas várias horas da perfuração esofágica. O enfisema subcutâneo quase nunca é visível em menos de 1 hora após a perfuração. Em cerca de 40% dos pacientes, o enfisema subcutâneo jamais ocorre.91 A presença e o momento em que ocorrem as alterações pleurais estão associados à integridade da pleura parietal mediastinal. Após o rompimento da pleura parietal mediastinal, a maioria dos pacientes desenvolve hidropneumotórax ou piopneumotórax.
Quando uma ruptura esofágica é considerada, uma radiografia do esôfago com contraste deve ser realizada imediatamente. A escolha do contraste limita-se a um composto iodado hidrossolúvel ou ao sulfato de bário.92 O bário proporciona a vantagem de uma maior densidade radiográfica e melhor aderência à mucosa, mas pode induzir uma reação a corpo estranho que pode resultar no desenvolvimento de granulomas pleurais e mediastinais, bem como em uma possível fibrose.92 Os agentes de contraste hidrossolúveis são rapidamente absorvidos e não causam reação inflamatória.92 As limitações destes compostos hidrossolúveis residem na hipertonicidade e em uma resposta inflamatória significativa, bem como na precipitação de edema pulmonar que pode ocorrer se o contraste for aspirado para dentro da árvore traqueobronquial. A radiografia esofágica com contraste é diagnóstica em 75 a 85% dos casos. Se não houver extravasamento de contraste, mas a suspeita clínica ainda for alta, recomenda-se repetir o exame. Quando os resultados radiográficos são indeterminados, uma TC pode documentar a presença de ar no mediastino. Nos pacientes certos, este tipo de achado torna a perfuração esofágica altamente provável.93 A toracocentese pode estabelecer o diagnóstico, uma vez que tenha havido ruptura da pleura mediastinal.
Em um paciente com mediastinite e sem ruptura esofágica, o líquido pleural constitui um exsudato com predominância de neutrófilos. Neste paciente, o pH está acima de 7,3, a concentração de glicose é maior que 60 mg/dL, e os níveis de amilase estão abaixo do limite normal máximo.66 Após a ruptura pleural parietal mediastinal, o paciente subsequentemente desenvolve um empiema anaeróbio. Se a infecção não for tratada, o pH do líquido pleural se torna baixo (tipicamente, entre 5 e 7). Este achado, associado a uma alta concentração de amilase (o que prova ser predominantemente salivar em análise isoenzimática), estabelece o diagnóstico. O líquido pleural apresenta elevado conteúdo proteico total, alta concentração de DHL (> 1.000 UI/L) e níveis de glicose substancialmente menores que 60 mg/dL. Além disso, a análise citológica do líquido pleural via concentração por centrifugação à alta velocidade pode revelar a existência de partículas de alimento não digeridas, igualmente confirmadoras do diagnóstico, as quais podem não ser detectáveis pela coloração de Gram e nas preparações a fresco.94 As células epiteliais escamosas observadas no exame citológico também podem ser confirmatórias.
Tratamento. A ruptura esofágica barogênica constitui uma emergência. Em uma revisão de 127 casos de pacientes com perfuração esofágica, constatou-se que o resultado era altamente dependente do momento em que o tratamento foi instituído. Quando o fechamento primário ocorria dentro de 24 horas após a ruptura, o resultado era excelente (isto é, taxa de sobrevida de 92%),95 porém depois de 24 horas a taxa de sobrevida apresentava uma piora substancial e nenhum tratamento se mostrou nitidamente superior. Os fatores relacionados ao diagnóstico tardio incluem a demora na apresentação do paciente; a falta de conhecimento, por parte do médico responsável pelo tratamento, acerca desta entidade rara; e a incerteza diagnóstica, devido aos sintomas inespecíficos que mimetizam outros processos patológicos. Quando o diagnóstico de ruptura esofágica barogênica é confirmado, o reparo primário deve ser realizado imediatamente. A drenagem dos espaços pleural e mediastinal deve ser realizada de acordo com a necessidade, e uma terapia antibiótica que inclua cobertura anaeróbia deve ser prontamente instituída.
O tratamento conservador tem se mostrado adequado para pacientes que apresentam ruptura cervical de pequenas proporções, que quase nunca é atribuída a causas barogênicas. O tratamento conservativo inclui terapia antibiótica com cobertura anaeróbia, sucção gástrica e NPT (sem líquidos fornecidos por via oral).
Migração extravascular de um cateter venoso central (CVC)
A inserção percutânea de um CVC é prática comum em casos de pacientes internados e pacientes ambulatoriais. É comum haver complicações, tais como pneumotórax, infecção e trombose. Entretanto, uma complicação potencialmente mais séria, cujo reconhecimento muitas vezes é tardio, consiste na migração do CVC com subsequente erosão e perfuração vascular.
A erosão produzida por cateter tem sido comumente relatada com o uso de cateteres no lado esquerdo, tendo como localização mais frequente a veia subclávia esquerda.78 A tendência de os cateteres de lado esquerdo causarem perfuração venosa é atribuída à orientação horizontal da veia braquiocefálica. Em adição, os cateteres de lado esquerdo com comprimento insuficiente tendem a entrar em contato com a veia cava superior, perto da perpendicular, aumentando a probabilidade de erosão e perfuração vascular. A zona precária para os cateteres de lado esquerdo é o recesso ázigo da veia cava superior proximal. Depois que a veia é perfurada, o líquido pode fluir para dentro do espaço pleural ou do mediastino.
Diagnóstico
As queixas mais comuns de um paciente alerta são a dispneia (80%) e a dor torácica (50%).78 Entre as manifestações incomuns, estão a tosse, o desconforto epigástrico e a síndrome de Horner (lesão nos nervos simpáticos da face que resulta em afundamento do globo ocular, contração de pupilas e pálpebras caídas). O diagnóstico costuma ser estabelecido com atraso. O tempo médio decorrido entre a erosão vascular e o diagnóstico é de 2 dias, porém a faixa de atraso é de 1 a 60 dias.78 O aparecimento insidioso da erosão, os sintomas inespecíficos e as condições médico-cirúrgicas subjacentes concomitantes parecem contribuir para a demora do diagnóstico.
Uma radiografia torácica frequentemente mostra a existência de efusão pleural, que pode ser uni ou bilateral. A efusão unilateral pode ser ipsi ou contralateral em relação ao sítio de inserção do cateter. O volume de efusão pode variar de pequeno a maciço, dependendo do momento em que a radiografia é obtida em relação ao tempo decorrido desde a migração do cateter. A ampliação mediastinal pode ser o único achado inicial. A associação da efusão pleural a uma localização anormal da ponta do cateter deve levantar a suspeita de perfuração. Outro sinal sugestivo de perfuração consiste na observação de um encurvamento de poucos centímetros da porção distal do cateter.96 A progressão dos sintomas na ausência de anormalidades evidentes nas radiografias torácicas é bastante incomum.
Os achados fornecidos pela análise do líquido pleural dependem do que foi infundido e do grau de traumatismo produzido pelo cateter. Exemplificando, se o paciente estiver recebendo NPT contendo lipídios, o líquido exibirá um aspecto leitoso. Quando a glicose é infundida, a proporção entre níveis de glicose no líquido pleural e no soro se torna substancialmente maior que 1, tendo sido relatada uma concentração absoluta de glicose no líquido pleural da ordem de 107 a 3.000 mg/dL. Todavia, a concentração de glicose pode não ser tão alta quanto previsto, devido ao rápido equilíbrio entre os níveis de glicose no líquido pleural e no sangue. Quando o infusato é salina, o líquido é um transudato, e a concentração proteica é inferior a 1 g/dL. A concentração de proteínas varia (de 0,3 a 2,3 g/dL), dependendo do conteúdo proteico do infusato, grau de inflamação, efeito das soluções hipertônicas e presença de hemorragia pleural.78
Os clínicos devem estar alertas para a possibilidade desta complicação e avaliar os pacientes com um sentido de urgência, diante da observação de aspectos clínicos compatíveis com a migração extravascular de cateter venoso. O aparecimento de novos sintomas cardiopulmonares, ampliação mediastinal, uma nova efusão pleural ou o aumento de proporções de uma efusão preexistente, o aumento da pressão venosa central aliado à hipotensão sistêmica, e um encurvamento ou localização extravascular do segmento distal do cateter são, todos, indícios do diagnóstico. A incapacidade de extrair sangue do cateter sustenta o diagnóstico, porém o retorno livre de sangue não tem poder de exclusão.
Tratamento
O melhor tratamento para casos de migração de cateter extravascular consiste na prevenção. A erosão vascular torna-se menos provável quando os cateteres são inseridos a partir do lado direito. O cateter deve ser posicionado paralelamente ao eixo longo da veia cava superior, com a extremidade distal voltada para o recesso ázigo.
Quando o diagnóstico de migração extravascular de cateter é estabelecido, o cateter deve ser removido. Se a efusão for pequena, justifica-se a observação. Quando uma efusão ampla provoca angústia respiratória ou hemotórax, torna-se necessário realizar uma toracocentese terapêutica ou inserir um tubo de toracostomia sem demora.
O autor não mantém relações comerciais com os fabricantes de produtos ou prestadores de serviços mencionados neste capítulo.
Referências
1. Light RW: Pleural Diseases, 3rd ed. Lippincott Williams & Wilkins, Baltimore, 1995, p 75
2. Mayo PH, Doelken P: Pleural ultrasonography. Clin Chest Med 27:215, 2006
3. Estenne M, Wyernault JC, Detroyer A: Mechanism of relief of dyspnea after thoracentesis in patients with large pleural effusions. Am J Med 74:813, 1983
4. Sahn SA, Heffner JE: Approach to the patient with pleurisy. Kelly’s Textbook of Internal Medicine, 2nd ed., Kelly WN, Ed. Lippincott Williams & Wilkins, Philadelphia, 1991, p 1887
5. Stelzner TJ, King TE, Antony VB, et al: The pleuropulmonary manifestations of the postcardiac injury syndrome. Chest 84:383, 1983
6. Henningsen NC, Cederbrug A, Hanson A, et al: Effects of long-term treatment with procainamide: a prospective study with special regard to ANF and SLE in fast and slow acetylators. Acta Med Scand 198:475, 1975
7. Sahn SA: Drug-induced pleural disease. Drug-Induced Iatrogenic Lung Disease. Camus P, Rosenow E, Eds. Hodder Arnold, London, 2007 (in press)
8. Sahn SA: Approach to the patient with a pleural effusion. Textbook of Pleural Diseases. Light RW, Lee YCG, Eds. Hodder Arnold, London, 2003, p 183
9. Sahn SA, Heffner JE: Pleural fluid analysis. Textbook of Pleural Diseases. Light RW, Lee YCG, Eds. Hodder Arnold, London, 2003, p 191
10. Light RW, MacGregor MI, Luchsinger PC, et al: Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med 77:507, 1972
11. Sahn SA: The pleura. Am Rev Respir Dis 138:184, 1988
12. Heffner JE, Brown LK, Barbieri C: Diagnostic value of tests that discriminate between exudative and transudative pleural effusions. Chest 111:970, 1997
13. Joseph J, Badrinath P, Basran G, et al: Is the pleural fluid transudate or exudates? A revisit of the diagnostic criteria. Thorax 56:867, 2001
14. Light RW, Erozan YS, Ball WC Jr: Cells in pleural fluid: their value and differential diagnosis. Arch Intern Med 132:854, 1973
15. Sahn SA: Diagnostic value of pleural fluid analysis. Semin Resp Crit Care Med 6:269, 1995
16. Martinez-Garcia MA, Case-Viedna E, Cordero-Rodriguez PJ, et al: Diagnostic utility of eosinophils in the pleural fluid. Eur Respir J 15:166, 2000
17. Heidecker JT, Kaplan AP, Sahn SA: Pleural fluid and peripheral eosinophilia from hemothorax: hypothesis for the pathogenesis of EPE in hemothorax adn pneumothorax. Am J Med Sci 332:148, 2006
18. Sahn SA: Pleural fluid pH in the normal state and in diseases affecting the pleural space. The Pleura in Health and Disease, Vol 30. Chretien J, Bignon J, Hirsch A, Eds. Marcel Dekker, New York, 1985, p 253
19. Miller KS, Wooten S, Sahn SA: Urinothorax: a cause of a low pH transudate. Am J Med 85:448, 1988
20. Heffner JE, Brown LK, Barbieri C: Pleural fluid chemical analysis in parapneumonic effusions: a meta-analysis. Am J Respir Crit Care Med 151:1700, 1995
21. Sahn SA, Good JT Jr: Pleural fluid pH in malignant effusions: diagnostic, prognostic, and therapeutic implication. Ann Intern Med 108:345, 1988
22. Heffner JE, Nietert PJ, Barbieri C: Pleural fluid pH as a predictor of survival for patients with malignant pleural effusions. Chest 117:79, 2000
23. Heffner JE, Nietert PJ, Barbierie C: Pleural fluid pH as a predictor of pleurodesis failure, analysis of primary data. Chest 117:87, 2000
24. Sahn SA: Pathogenesis and clinical features of diseases associated with a low pleural fluid glucose. The Pleura in Health and Disease, Vol 30. Chretien J, Bignon J, Hirsch A, Eds. Marcel Dekker, New York, 1985, p 267
25. Light RW, Ball WC Jr: Glucose and amylase in pleural effusions. JAMA 225:257, 1973
26. Joseph J, Viney S, Beck P, et al: A prospective of amylase-rich pleural effusion with special reference to amylase isoenzyme analysis. Chest 102:1455, 1992
27. Kramer MR, Sepero RJ, Pitchenik AE: High amylase in neoplasm-related pleural effusion. Ann Intern Med 110:567, 1989
28. Staats BA, Ellefson RD, Budahn LL, et al: The lipoprotein profile of chylous and nonchylous pleural effusions. Mayo Clin Proc 55:700, 1980
29. Hamm H, Phalzer B, Fabel H: Lipoprotein analysis in a chyliform pleural effusion: implications for pathogenesis and diagnosis. Respiration 58:294, 1991
30. Coe JE, Aikawa JK: Cholesterol pleural effusion. Arch Intern Med 108:763, 1961
31. Valdes L, Alvarez D, San Jose E, et al: Tuberculous pleurisy: a study of 254 patients. Arch Intern Med 158:2017, 1998
32. Gopi A, Madhvan S, Sharma S, Sahn SA: Diagnosis and treatment of tuberculous pleural effusion in 2006. Chest 131:880, 2007
33. Grunze H: The comparative diagnostic accuracy, efficacy, and specificity of cytologic techniques used in the diagnosis of malignant neoplasm and serous effusions of the pleuroperitoneal cavities. Acta Cytol 8:156, 1964
34. Jarvi OH, Kunnas RJ, Laitio MT, et al: The accuracy and significance of the cytologic cancer diagnosis of pleural effusions. Acta Cytol 16:152, 1972
35. Sahn SA: Malignant pleural effusions. Semin Respir Med 9:43, 1987
36. Moriarty AT, Weirscma L, Snyder W, et al: Immunophenotyping of cytologic specimens by flow cytometry. Diag Cytopathol 9:252, 1993
37. Marel M, Zrustova M, Stastny B, et al: The incidence of pleural effusion in a well-defined region: epidemiologic study in central Bohemia. Chest 104:1486, 1993
38. Kataoka H: Pericardial and pleural effusions in decompensated chronic heart failure. Am Heart J 139:918, 2000
39. Race GA, Scheifly CH, Edwards JE: Hydrothorax and congestive heart failure. Am J Med 22:83, 1957
40. Weiner-Kronish JP, Metthay MA, Callen PW, et al: Relationship of pleural effusions to pulmonary hemodynamics in patients with congestive heart failure. Am Rev Resp Dis 132:1253, 1985
41. Johnston RF, Loo RV: Hepatic hydrothorax. Ann Intern Med 61:385, 1964
42. Lieberman FL, Peters RL: Cirrhotic hydrothorax. Arch Intern Med 125:114, 1970
43. Xiol X, CastelloteJ, Cortes-Beut R, et al: Usefulness and complications of thoracentesis in cirrhotic patients. Am J Med 111:67, 2001
44. Cavina C, Vichi G: Radiological aspects of pleural effusions in medical nephropathy in children. Ann Radiol Diagn (Bologna) 31:163, 1958
45. Llach F, Arieff AI, Massry SG: Renal vein thrombosis and nephrotic syndrome: a prospective study of 36 adult patients. Ann Intern Med 83:8, 1975
46. Doelken P, Sahn SA: Trapped lung. Semin Respir Crit Care Med 22:631, 2001
47. Huggins JT, Sahn SA, Heidecker J, et al: Characteristics of trapped lung: pleural fluid analysis, manometry, and air-contrasts chest computed tomography. Chest 131:206, 2007
48. Sahn SA: Management of complicated parapneumonic effusions. Am Rev Respir Dis 148:813, 1993
49. Light RW, Girard WM, Jenkinson SG, et al: Parapneumonic effusions. Am J Med 69:507, 1980
50. Maskell NA, Davies CW, Nunn AJ, et al: UK controlled trial of intrapleural streptokinase for pleural infection. N Engl J Med 352:865, 2005
51. Sahn SA: Malignant pleural effusions. Pulmonary Diseases and Disorders, 4th ed. Fishman AP, Elias JA, Fishman JA, et al, Eds. McGraw Hill, New York, 2007 (in press)
52. Meyer PC: Metastatic carcinoma of the pleura. Thorax 21:437, 1966
53. Chernow B, Sahn SA: Carcinomatous involvement of the pleura: an analysis of 96 patients. Am J Med 63:695, 1977
54. Bynum LJ, Wilson JE 3rd: Radiographic features in pulmonary embolism. Am Rev Respir Dis 17:829, 1978
55. Bynum LJ, Wilson JE 3rd: Characteristics of pleural effusions associated with pulmonary embolism. Arch Intern Med 136:159, 1976
56. Berger HW, Mejia E: Tuberculous pleurisy. Chest 63:88, 1973
57. Seibert AF, Haynes J Jr., Middelton R, et al: Tuberculous pleural effusion: 20 years experience. Chest 99:883, 1991
58. Bass JB, Farer LS, Hopewell PC, et al: Treatment of tuberculosis and tuberculous infection in adults and children. Am J Respir Crit Care Med 149:1359, 1994
59. Dutt AK, Moers D, Stead WW: Tuberculous pleural effusion: six-month therapy isoniazid and rifampin. Am Rev Respir Dis 145:1429, 1992
60. Roper WH, Waring JJ: Primary serofibrinous pleural effusion in military personnel. Am Rev Tuberc 71:616, 1955
61. Joseph J, Sahn SA: Connective tissue diseases and the pleura. Chest 104:262, 1993
62. Stanford RE: Rheumatoid and other collagen lung disease. Semin Respir Med 4:107, 1982
63. Faurschou P, Francis D, Farrup P: Thoracoscopic, histological, and clinical findings in nine cases of rheumatoid pleural effusion. Thorax 480:371, 1985
64. Pettersson T, Klockars M, Hellstrom PE: Chemical and immunological features of pleural effusions: comparison between rheumatoid arthritis and other diseases. Thorax 37:354, 1982
65. Nosanchuk JS, Naylor B: A unique cytologic picture in pleural fluid from patients with rheumatoid arthritis. Am J Clin Path 50:330, 1968
66. Sahn SA: Pleural effusions of extravascular origin. Clin Chest Med 27:285, 2006
67. Nomoto Y, Suga T, Nakajima K, et al: Acute hydrothorax and continuous ambulatory peritoneal dialysis: a collaborative study of 161 centers. Am J Nephrol 9:363, 1989
68. Rudnick MR, Coyle JF, Beck LH, et al: Acute massive hydrothorax complicating peritoneal dialysis, report of two cases and a review of the literature. Clin Nephrol 12:38, 1979
69. Camilleri B, Glancey G, Pledger D, et al: The icodextrin black-line sign to confirm a pleural leak in a patient on peritoneal dialysis. Perit Dial Int 24:167, 2004
70. Salcedo JR: Urinothorax: report of four cases and review of literature. J Urol 35:805, 1986
71. Lallas CD, Delvecchio FC, Evans BR, et al: Management of nephropleural fistula after supracostal percutaneous nephrolithotomy. Urology 64:242, 2004
72. Stark DD, Shanes JG, Baron RL, et al: Biochemical features of urinothorax. Arch Intern Med 142:1509, 1982
73. Lloyd C, Sahn SA: Subarachnoid pleural fistula due to penetrating trauma: case report and review of the literature. Chest 122:2252, 2002
74. Huggins JT, Sahn SA: Duro-pleural fistula diagnosed by â2-transferrin. Respiration 70:423, 2003
75. Skedros DG, Cass SP, Hirsch BE, et al: â2-Transferrin assay in clinical management of cerebral spinal fluid and perilymphatic fluid leaks. J Otolaryngol 22:341, 1993
76. Lim K, Rosenow ER, Staats B, et al: Chyloptysis in adults: presentation, recognition, and differential diagnosis. Chest 125:336, 2004
77. Miller JJ: Anatomy of the thoracic duct and chylothorax. General Thoracic Surgery, 6th ed. Shields T, Locicero J, Ponn R, et al, Eds. Lippincott Williams & Wilkins, Philadelphia, 2005, p 879
78. Duntley P, Siever J, Korlwes M, et al: Vascular erosion by central venous catheters: clinical features and outcome. Chest 101:1633, 1992
79. Cope C: Management of chylothorax via percutaneous embolization. Curr Opin Pulm Med 10:311, 2004
80. Demos NJ, Kozel J, Scerbo JE: Somatostatin in the treatment of chylothorax. Chest 119:964, 2001
81. Kaman L, Behera A, Singh R, et al: Internal pancreatic fistulas with pancreatic ascites and pancreatic pleural effusions: recognition and management. ANZ J Surg 71:221, 2001
82. Uchiyama T, Suzuki T, Adachi A, et al: Pancreatic pleural effusion: case report and review of 113 cases in Japan. Am J Gastroenterol 87:387, 1992
83. Parekh D, Segal I: Pancreatic ascites and effusion: risk factors for failure of conservative therapy and the role of octreotide. Arch Surg 127:707, 1992
84. Rockey DC, Cello JP: Pancreatopleural fistula: report of seven patients and review of the literature. Medicine 69:332, 1990
85. Lang EK, Paolini RM, Pottmeyer A: The efficacy of palliative and definitive percutaneous versus surgical drainage of pancreatic abscesses and pseudocysts: a prospective study of 85 patients. Southern Med J 84:55, 1991
86. Ferguson T: Esophageal perforations and mediastinal sepsis in critical surgical illness. Critical Surgical Illness. 2nd ed. Hardy JD, Ed. WB Saunders, Philadelphia, 1980, p 270. Michel L, Grillo H, Malt R: Esophageal perforation. Ann Thorac Surg 283:203, 1981
87. Campbell TC, Andrews JL, Neptune WB: Spontaneous rupture of the esophagus (Boerhaave syndrome): necessity of early diagnosis and treatment. JAMA 235:526, 1976
88. Mackler SA: Spontaneous rupture of the esophagus; experimental and clinical study. Surg Gynecol Obstet 95:345, 1952
89. Parkin GJ: The radiology of perforated oesophagus. Clin Radiol 24:324, 1973
90. O’Connell ND: Spontaneous rupture of the esophagus. Am J Roentgenol Radium Ther Nucl Med 99:186, 1967
91. Foley MJ, Ghahremani GG, Rogers LF: Reappraisal of contrast media used to detect upper gastroesophageal perforations, comparison of ionic water-soluble media with barium sulfate. Radiology 144:231, 1982
92. Jaworski A, Fischer R, Lippmann M: Boerhaaves’s syndrome: computed tomographic findings and diagnostic considerations. Arch Intern Med 148:223, 1988
93. Drury M, Anderson W, Heffner JE: Diagnostic value of pleural fluid cytology in occult Boerhaave’s syndrome. Chest 102:976, 1992
94. Bladergroen M, Lowe J, Postlethwait R: Diagnosis and recommended management of esophageal perforation and rupture. Ann Thorac Surg 42:235, 1986
95. Au FC, Badellino M: Significance of a curled central venous catheter tip. Chest 93:890, 1988.