Psoríase
Elizabeth A. Abel, MD
Clinical Professor of Dermatology, Stanford University School of Medicine
Mark Lebwohl, MD
Sol and Clara Kest Professor and Chairman, Department of Dermatology, Mount Sinai Medical Center
Artigo original: Abel EA, Lebwohl M. Psoriasis. ACP Medicine. 2008;1-14.
[The original English language work has been published by DECKER INTELLECTUAL PROPERTIES INC. Hamilton, Ontario, Canada. Copyright © 2011 Decker Intellectual Properties Inc. All Rights Reserved.]
Tradução: Soraya Imon de Oliveira.
Revisão técnica: Dr. Rodrigo Antônio Brandão Neto
A psoríase é um distúrbio inflamatório cutâneo caracterizado pela formação de placas e manchas eritematomas, descamantes e crônicas na pele. Pode surgir em qualquer idade e apresentar gravidade variável. A psoríase pode manifestar-se de diversas formas, incluindo as variantes pustular e eritrodérmica. Além do envolvimento da pele, a psoríase com frequência envolve as unhas, e alguns pacientes podem apresentar inflamação articular (artrite psoriática). Por sua natureza altamente visível, a psoríase pode comprometer a vida pessoal e profissional de suas vítimas.
Os avanços ocorridos na área do tratamento da psoríase levaram a uma melhor compreensão de sua patogênese. Este capítulo revisa o conhecimento atual sobre a genética, a patogênese e o tratamento da psoríase.
Epidemiologia
Estima-se que a prevalência aproximada da psoríase varie de 0,5 a 4,6%, em termos mundiais. Os motivos desta ampla variação geográfica da prevalência são desconhecidos, mas o clima e a genética podem exercer algum papel. A psoríase é incomum entre os afrodescendentes que vivem nas zonas tropicais, contudo é observada com mais frequência entre os afrodescendentes que vivem nas zonas temperadas. Sua ocorrência é comum entre os japoneses, porém é rara entre os indivíduos que vivem nas Américas do Norte e do Sul. Nos Estados Unidos, relatos variados de diversos estudos apontam que 4,5 milhões de adultos1 ou 7 milhões de adultos e crianças2 têm psoríase.
A psoríase pode ocorrer em qualquer idade. Há relatos de casos de psoríase ao nascimento e em indivíduos com mais de 100 anos. No estudo pioneiro de Farber e Nall, que envolveu 5.600 pacientes, a média da idade dos pacientes no momento do aparecimento da psoríase era 27,8 anos. Em 35% dos pacientes, o aparecimento da condição ocorreu antes dos 20 anos de idade, enquanto em 10% dos casos a condição surgiu antes dos 10 anos.3 Embora a psoríase ocorra com a mesma frequência em indivíduos de ambos os sexos, o aparecimento da condição, no estudo de Farber e Nall, foi mais tardio nos homens. Nas populações em que a prevalência da psoríase é alta, o aparecimento da condição tende a ocorrer mais cedo. Nas ilhas Faroe, por exemplo, a prevalência da psoríase é 3%, e a média da idade dos pacientes no momento do aparecimento é 12,5 anos. Nos Estados Unidos, a média de idade no momento do aparecimento da psoríase é 23 anos. Nos indivíduos em que a doença surge mais cedo, a psoríase tende a ser mais grave, com envolvimento de uma ampla área de superfície da pele.
Patogênese
A psoríase já foi considerada uma doença causada por uma anormalidade cinética das células epidérmicas. Hoje, acredita-se que uma anormalidade envolvendo o sistema imune desencadeie a proliferação epidérmica. O papel dos linfócitos ativados no desenvolvimento da psoríase foi comprovado pela primeira vez por intermédio da investigação da DAB389 interleucina-2 (IL-2), uma proteína de fusão que consiste em moléculas de IL-2 fundidas à toxina diftérica. Esta proteína de fusão liga-se a receptores de IL-2 de alta afinidade existentes nas células T ativadas que, em consequência, são destruídas. Em um estudo sobre o tratamento com DAB389 IL-2 de 10 pacientes, quatro pacientes apresentaram uma drástica melhora clínica e outros quatro apresentaram melhora moderada.4 Contudo, os efeitos colaterais produzidos pelo DAB389 IL-2 impedem a aprovação do uso deste agente no tratamento da psoríase.5
A pele de pacientes com lesões de psoríase possui um número maior de células apresentadoras de antígeno capazes de ativar células T, em comparação à pele de indivíduos saudáveis. Para que as células T sejam ativadas, as células apresentadoras de antígeno devem emitir ao menos dois sinais para as células T em repouso. O primeiro sinal ocorre quando as moléculas do complexo principal de histocompatibilidade (MHC) de classe II das células apresentadoras de antígeno são apresentadas para as células T. Um segundo sinal coestimulatório deve ser emitido via interação dos ligantes existentes na superfície das células apresentadoras de antígeno com receptores presentes na superfície das células T. Alguns exemplos deste processo incluem a interação das moléculas B7 com o CD28 presente na superfície das células T em repouso, a interação entre o antígeno associado à função linfocitária 3 (LFA-3) e o CD2, ou a interação da molécula de adesão intercelular-1 (ICAM-1) com o LFA-1 na superfície das células T.6,7 O bloqueio de qualquer uma destas etapas resulta na depuração da psoríase.8,9 Mediante ativação, as células T liberam citocinas do tipo T auxiliar 1 (Th1, do inglês T helper 1), IL-2 e interferon-gama. Estas citocinas induzem proliferação de queratinócitos e estimulação adicional das células T. Citocinas inflamatórias, como o fator de necrose tumoral-alfa (TNF-alfa), são encontradas nas articulações e lesões cutâneas psoriáticas, sendo que o tratamento com bloqueadores de TNF-alfa resulta na depuração da psoríase e da artrite psoriática.10
Embora a psoríase já tenha sido considerada uma doença associada à resposta Th1, trabalhos recentes apontam um papel importante para as células Th17 na patogênese da psoríase. A IL-23 produzida pelos queratinócitos e células dendríticas conduz a via de Th17. As células Th17 secretam IL-17, IL-22, IL-6 e TNF-alfa. O papel destas últimas três citocinas é considerado importante na psoríase.11 Não é surpreendente observar que os fármacos que bloqueiam o componente p40 da IL-23 exercem impacto profundo sobre a atividade desta citocina e produzem uma melhora drástica da psoríase.12
Etiologia
Fatores genéticos
Várias linhas de evidência sugerem que a psoríase tem etiologia genética. Uma história familiar positiva é encontrada em 1/3 dos indivíduos afetados. Estudos descobriram um índice de concordância maior entre gêmeos monozigóticos do que entre gêmeos dizigóticos ou irmãos não gêmeos (70% vs. 23%).13
Evidências atuais sugerem a existência de heterogeneidade genética. Ambas as formas de herança, autossômica dominante com penetrância incompleta e poligênica ou multifatorial, foram descritas. Dentre os genes determinantes de suscetibilidade à psoríase (PSORS), o mais importante parece ser o gene PSORS1, que foi mapeado na região cromossômica 6p21, codificadora do MHC.14 Vários estudos confirmaram a existência de um segundo gene determinante de suscetibilidade, PSORS2, localizado no cromossomo 17q24-q25.15,16 Este locus contém vários genes envolvidos na imunorregulação, sugerindo um possível papel na patogênese da psoríase. Ao menos sete outros genes PSORS foram propostos.
Mais recentemente, foi comprovado que uma mutação no gene codificador do receptor da IL-23 confere proteção contra a psoríase.17,18 A variação comum deste gene está associada à suscetibilidade à psoríase.
Fatores contribuintes
O curso e a gravidade da psoríase podem ser afetados por vários fatores endógenos e exógenos, incluindo o estresse, o clima, infecções concomitantes e medicações.
Estresse psicológico
Muitos pacientes acreditam que a ansiedade ou o estresse psicológico exercem efeito adverso sobre o curso da psoríase. Contudo, é difícil avaliar a importância etiológica do estresse na psoríase, devido à natureza subjetiva das evidências usadas em muitas das investigações sobre este assunto.19 Em um estudo prospectivo, um método estatístico de variância múltipla revelou a existência de uma correlação positiva entre a gravidade dos sintomas da psoríase e o estresse psicológico associado a eventos adversos da vida.20 A própria psoríase pode ser fonte de estresse: os efeitos da psoríase sobre a função física e mental foram comparados aos efeitos do câncer, cardiopatia, diabetes e depressão.21
Clima
Há muito tempo, sabe-se que a psoríase melhora quando os pacientes são expostos a climas ensolarados e regiões de baixa latitude. Nas latitudes norte, a exacerbação da psoríase costuma ocorrer durante o outono e o inverno.
Infecção
As infecções virais ou bacterianas, em especial a tonsilite ou faringite estreptocócica, podem precipitar o aparecimento ou exacerbação da psoríase.22 A psoríase em gota, particularmente, costuma ser atribuída a um infecção prévia por estreptococos. As tentativas de reverter a psoríase por meio do tratamento com antibióticos orais mostraram-se inefetivas em estudos duplo-cego.23 Mesmo assim, alguns pesquisadores defendem o tratamento da psoríase com antibióticos.24
A infecção por HIV também foi associada à psoríase. Alguns pacientes infectados pelo HIV sofrem exacerbação da psoríase preexistente, enquanto em outros a psoríase se desenvolve no decorrer de alguns anos após a infecção pelo HIV. Com frequência, os pacientes infectados pelo HIV apresentam sintomas similares aos da síndrome de Reiter.25
Fármacos
Numerosos fármacos podem piorar a psoríase.26 Agentes antimaláricos, como a cloroquina, podem causar eritroderma esfoliativo ou psoríase pustular. Até 31% dos pacientes apresentam novo episódio ou piora da psoríase como resultado da terapia antimalárica. O lítio e os betabloqueadores, como o propranolol, podem precipitar o aparecimento ou causar exacerbação da psoríase.27 Alguns fármacos anti-inflamatórios não hormonais (AINH) também exacerbam a psoríase, embora este efeito seja suficientemente menor a ponto de possibilitar o uso destes agentes no tratamento da artrite psoriática.28 Os ataques de psoríase pustular podem ser precipitados pela retirada dos corticosteroides sistêmicos ou dos corticosteroides tópicos de alta potência. A terapia com interferon foi associada ao desenvolvimento ou exacerbação da psoríase, provavelmente por causa dos efeitos Th1 que produz.29 De modo paradoxal, os bloqueadores de TNF-alfa que são altamente efetivos para o tratamento da psoríase podem induzir a doença em raros casos de pacientes com enteropatia inflamatória ou artrite reumatoide.30,31 As lesões cutâneas, em muitos casos, envolvem as palmas das mãos e solas dos pés ou genitais. A psoríase pode se resolver após a descontinuação do inibidor de TNF-alfa, mas também recorrer com a retomada do tratamento, mesmo que seja usado um bloqueador de TNF-alfa diferente.
Outros fatores
O traumatismo na pele clinicamente não envolvida de pacientes com psoríase pode causar o aparecimento de uma lesão exatamente no sítio traumatizado. Este fenômeno é conhecido como fenômeno de Köbner. Cortes, abrasões, injeções, queimaduras resultantes de fototerapia e outras formas de traumatismo podem deflagrar esta reação.
Na psoríase, o tabagismo pode atuar como fator exacerbador.32 O consumo de bebidas alcoólicas também foi implicado na exacerbação da psoríase.33
Levantamentos sugeriram que a dieta exerce algum papel no desenvolvimento da psoríase. Tentativas foram empreendidas no sentido de influenciar o curso clínico da psoríase por meio da modificação da dieta.34 No entanto, estudos duplo-cegos falharam em mostrar que a dieta exerce efeito benéfico ou detrimental sobre a gravidade desta condição.
Diagnóstico
O diagnóstico da psoríase costuma ser estabelecido com base no quadro clínico. Diante da existência de aspectos incomuns, uma biópsia da pele afetada pode ser obtida para confirmar o diagnóstico.
Variantes clínicas
Quase 90% dos pacientes com psoríase têm psoríase em placa, que é uma forma caracterizada pelo aparecimento de placas precisamente delimitadas, eritematosas e descamantes. Os cotovelos [Figura 1], joelhos e couro cabeludo [Figura 2] são os sítios mais comumente afetados. A fenda interglútea [Figura 3], as palmas das mãos [Figura 4], solas dos pés [Figura 5] e genitais também são comumente afetados, contudo a psoríase pode envolver qualquer parte do corpo. As lesões com frequência seguem um padrão de distribuição simétrico.
____________________________________________________________
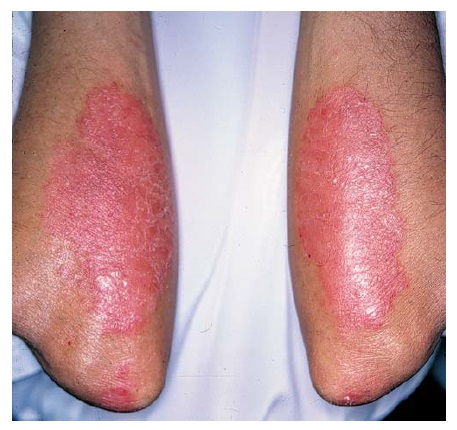
Figura 1. O envolvimento dos cotovelos é característico da psoríase em placa.
____________________________________________________________
____________________________________________________________
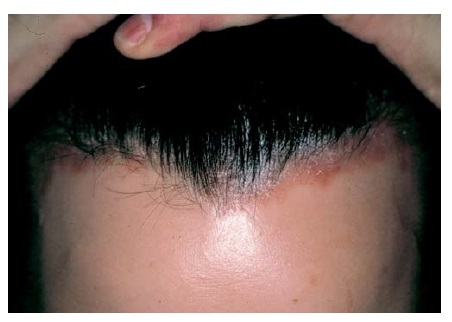
Figura 2. O escalpo é afetado na maioria dos pacientes com psoríase em placa.
____________________________________________________________
____________________________________________________________
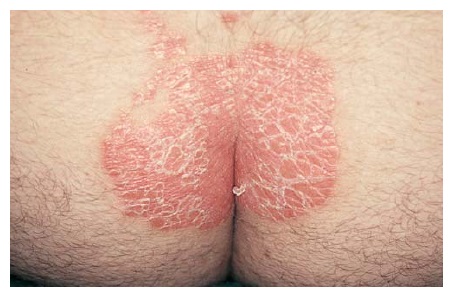
Figura 3. A fenda interglútea é um sítio de envolvimento comum em pacientes com psoríase em placa.
____________________________________________________________
____________________________________________________________
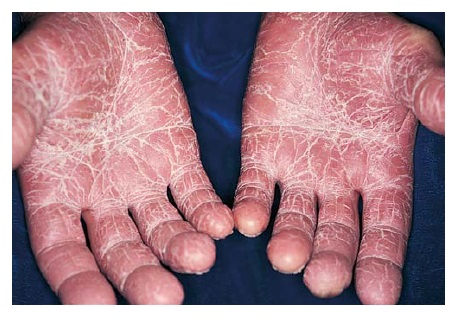
Figura 4. Este paciente apresenta psoríase nas palmas das mãos.
____________________________________________________________
____________________________________________________________
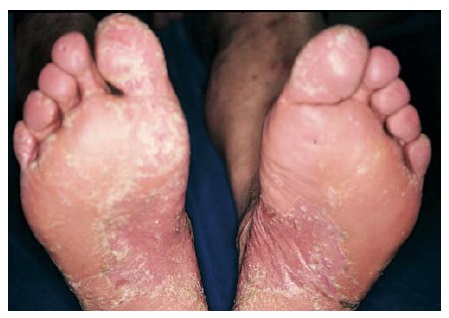
Figura 5. Placas precisamente demarcadas, eritematosas e descamantes evidentes nos pés de um paciente com psoríase nas solas dos pés.
____________________________________________________________
Muitos pacientes possuem apenas uma ou poucas lesões que persistem por anos e ocasionalmente se resolvem após a exposição à luz solar. Outros pacientes podem ter o corpo coberto com placas que se tornam confluentes, afetando quase 100% da área de superfície corporal. O envolvimento ungueal é comum, em particular em pacientes com doença grave.
A segunda forma mais comum de psoríase – a psoríase em gota – afeta menos de 10% dos pacientes e é caracterizada pelo desenvolvimento de pequenas pápulas eritematosas e descamantes ao longo do tronco e dos membros [Figura 6]. Esta forma de psoríase ocorre, com frequência, após a infecção estreptocócica. Os pacientes com psoríase em placa podem desenvolver psoríase em gota. Contudo, a maioria dos pacientes com psoríase em gota desenvolve psoríase em placa. Ocasionalmente, as lesões em gota aumentam de tamanho e tornam-se confluentes, resultando na formação de placas.
________________________________________________________
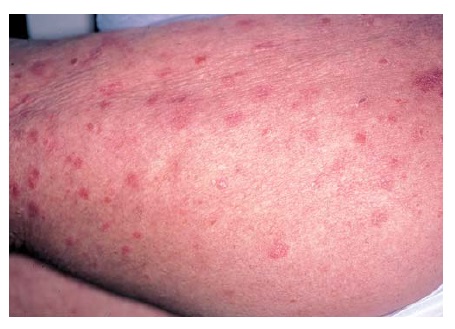
Figura 6. A psoríase em gota é caracterizada por pequenas pápulas e placas descamantes.
________________________________________________________
A psoríase eritrodérmica é uma forma grave de psoríase que costuma afetar toda a superfície cutânea. Os pacientes apresentam eritroderma esfoliativo, em que a pele se torna bastante avermelhada e inflamada, além de descamar constantemente [Figura 7]. Os pacientes apresentam doença aguda, e sua pele perde totalmente a função protetora. A perda do controle da temperatura, a perda de líquidos e nutrientes através da pele comprometida, e a suscetibilidade a infecção fazem com que esta condição se torne potencialmente prejudicial à vida.
________________________________________________________
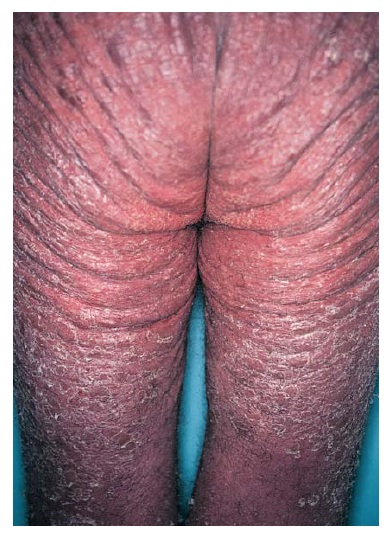
Figura 7. A psoríase eritrodérmica é caracterizada por descamação e eritema generalizado.
________________________________________________________
A psoríase eritrodérmica pode desenvolver-se de novo ou evoluir a partir da típica psoríase em placa ou em gota. A psoríase eritrodérmica pode ocorrer após a retirada dos corticosteroides sistêmicos, queimaduras de fototerapia, em consequência do tratamento antimalárico, como resultado de reações de hipersensibilidade fármaco-induzidas, ou até mesmo na ausência de um motivo evidente. O linfoma cutâneo de células T também se manifesta como eritroderma e precisa ser diferenciado da psoríase eritrodérmica.
A psoríase pustular (outra forma severa da doença) pode ocorrer em pacientes com psoríase preexistente ou pode surgir de novo. A psoríase pustular pode ser generalizada (tipo von Zumbusch) ou localizada nas palmas das mãos e solas dos pés [Figura 8]. Em ambos os casos, a condição é grave e debilitante. Na psoríase pustular generalizada, o corpo fica coberto de pústulas estéreis. Assim como na psoríase eritrodérmica, as funções protetoras da pele são pedidas e os pacientes podem sucumbir à infecção ou hipovolemia e ao desequilíbrio eletrolítico causado pela perda de líquido através da pele. Embora a febre e a leucocitose sejam aspectos comuns da psoríase pustular, a possibilidade de infecção não deve ser subestimada. Os pacientes com psoríase pustular têm morrido em decorrência de sepse estafilocócica.35
_____________________________________________________________
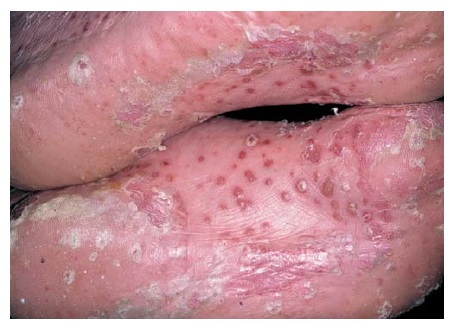
Figura 8. A psoríase pustular pode ser localizada nas palmas das mãos e solas dos pés, ou generalizada.
_____________________________________________________________
Psoríase ungueal
As alterações que ocorrem nas unhas podem ter valor imensurável nos casos em que o diagnóstico é duvidoso [Figura 9]. Em um estudo, 55% dos pacientes com psoríase apresentaram alterações nas unhas.36 A alteração mais comum consiste no aparecimento de minúsculas escavações, semelhantes àquelas produzidas com um picador de gelo, frequentemente agrupadas. Esta típica escavação das unhas é altamente específica para a psoríase, embora algumas escavações isoladas possam ser observadas em unhas sadias ou como resultado de traumatismos. A descoloração amarelada é comumente encontrada nas unhas dos dedos do pé psoriáticas e também podem surgir nas unhas dos dedos da mão. A onicólise, ou separação distal da placa ungueal de seu leito, ocorre com frequência.
____________________________________________________________
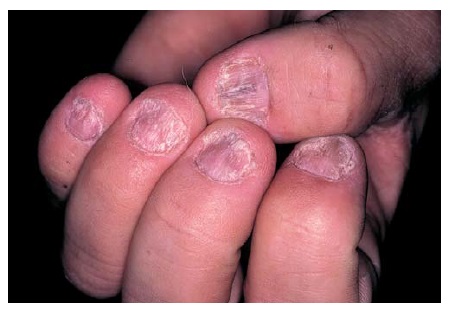
Figura 9. O envolvimento das unhas é comum na psoríase.
____________________________________________________________
Outras alterações incluem a hiperceratose subungueal – um acúmulo de debris queratinosos embaixo da unha – e o enrugamento transversal e longitudinal. Entretanto, estes achados são bem mais inespecíficos, pois também ocorrem de modo secundário à dermatite, infecção fúngica, insuficiência vascular e outras condições. Ocasionalmente, alguns pacientes apresentam alterações ungueais típicas da psoríase sem nenhum sinal cutâneo adicional ao exame inicial. É provável que todos estes pacientes sejam psoriáticos e, eventualmente, podem manifestar lesões psoriáticas.
Artrite psoriática
Estima-se que a artrite psoriática ocorra em 7 a 42% dos pacientes com psoríase.37 A inflamação articular associada à artrite psoriática é crônica, com remissões ocasionais.38 Existem cinco subtipos clássicos desta condição. Sua manifestação mais comum é uma oligoartrite, em que uma ou poucas articulações são afetadas. Esta forma contribui para cerca de 70% dos casos de artrite psoriática. As lesões cutâneas da psoríase geralmente precedem a doença articular em 5 a 10 anos, contudo a inflamação articular se desenvolve antes das lesões cutâneas, em alguns pacientes. Diante da suspeita de um diagnóstico de artrite psoriática, o médico deve examinar atentamente o couro cabeludo, unhas, fenda interglútea, canal auditivo externo e região genital, em busca de lesões psoriáticas.
O segundo tipo mais comum de artrite psoriática é quase idêntico à artrite reumatoide. Esta forma é caracterizada pelo envolvimento simétrico das articulações, com desvio ulnar e deformações típicas, como se observa na deformação em pescoço de cisne e na deformação em botoeira. Os únicos aspectos distintivos são a presença da psoríase e a ausência de fator reumatoide circulante.
A artrite mutilante é uma forma rara e gravemente destrutiva de artrite psoriática, em que as articulações interfalângicas das mãos e dos pés são destruídas, resultando na deformação dos dedos. A espondilite anquilosante contribui para 5% dos casos de artrite psoriática. Assim como em outras formas de espondilite anquilosante, o marcador genético HLA-B27 geralmente está presente.
O envolvimento da articulação interfalângica distal é a forma mais característica da artrite psoriática. Esta condição geralmente está associada ao envolvimento ungueal.
Nota do editor: Cerca de 5% dos casos de artrite psoriática tem a forma de espondilite. Ainda existe na opinião de alguns autires uma sexta forma de apresentação da artrite psoriática, que é a chamada síndrome SAPHO (sinovite + acne + pustulose palmo plantar + hiperostose esterno-costo-clavicular + osteíte multifocal crônica recorrente).
Outras manifestações podem ser entesites, principalmente no tendão de Aquiles e fáscia plantar. Envolvimento ocular tem sido observado em um terço dos pacientes. Complicações como insuficiência aórtica, uveíte, fibrose pulmonar de lobos superiores e amiloidose podem ocorrer, porém são raros.
Histopatologia
Os aspectos microscópicos clássicos de uma placa psoriática incluem:
O espessamento marcante do estrato córneo, com zonas sobrepostas de paraceratose (retenção de núcleos);
Epiderme moderada a acentuadamente hiperplásica, com ampliação das projeções em rede e alongamento até uma profundidade uniforme na derme;
Atividade mitótica aumentada na epiderme inferior;
Adelgaçamento da epiderme sobre as papilas dérmicas;
Pequena quantidade de infiltração inflamatória, a partir das células mononucleares existentes na derme superficial;
Acúmulos intra ou subcorneais de leucócitos polimorfonucleares (microabscessos de Munro).
Diagnóstico diferencial
O diagnóstico diferencial da psoríase inclui outras dermatoses descamantes [ver 2:II Distúrbios papuloescamosos]. Neste tipo de dermatoses, estão incluídas:
Dermatite seborreica, que envolve o couro cabeludo, pregas nasolabiais e pregas retroauriculares;
Pitiríase rosa, que começa com uma placa precursora e é autolimitada;
Líquen simples crônico, que é causado por atrito ou raspagens repetidas;
Parapsoríase, que é caracterizada por atrofia, telangiectasia e anormalidades pigmentares;
Pitiríase rubra pilosa, caracterizada por placas psoriaseformes que muitas vezes surgem em áreas expostas à luz solar;
Outras condições (p. ex., eczema discoide ou sífilis secundária), que podem ser diferenciadas por critérios clínicos e patológicos.
Tratamento
Existem mais tratamentos disponíveis para a psoríase do que, talvez, para qualquer outra doença dermatológica. Foram introduzidas novas terapias tópicas, novas terapias sistêmicas e novas formas de fototerapia. Além disso, tratamentos adicionais estão sendo desenvolvidos. As terapias biológicas dirigidas contra moléculas-alvo específicas tendem a mudar o tratamento da psoríase no futuro. Mesmo assim, a terapia tópica continuará sendo usada pela maioria dos pacientes.
Terapia tópica
A terapia tópica é a base do tratamento da psoríase, em particular dos casos brandos. Os corticosteroides tópicos são a classe de medicamentos mais comumente prescrita, mas hoje costumam ser prescritos com calcipotrieno tópico (um análogo da vitamina D3) ou tazaroteno tópico (um retinoide). Ambos, calcipotrieno e tazaroteno, foram aprovados pelo Food and Drug Administration (FDA) para uso no tratamento da psoríase.39 O alcatrão e o ácido salicílico são disponibilizados mediante prescrição e também como produtos vendidos sem prescrição médica. O uso da antralina diminuiu com a disponibilização dos agentes não esteroides efetivos.
Os emolientes são parte importante de qualquer regime tópico para tratamento da psoríase. A aplicação apenas de petrolato pode ser suficiente como terapia para alguns pacientes. Cremes e loções mais refinados são úteis, mas são menos efetivos do que as pomadas gordurosas. Os xampus à base de alcatrão e ácido salicílico são valiosos no tratamento de pacientes com envolvimento do couro cabeludo. Estas preparações são disponibilizadas sem prescrição.
Corticosteroides
Os corticosteroides tópicos são indicados para placas limitadas de psoríase. Por serem fáceis de usar e amplamente disponíveis, os corticosteroides tópicos são os medicamentos mais comumente prescritos para tratamento da psoríase. Seus efeitos são anti-inflamatórios, antiproliferativos e antipruriginosos. Os corticosteroides são mais potentes quando aplicados sob oclusão, o que aumenta a penetração percutânea. Contudo, a oclusão também aumenta os efeitos colaterais.
Os esteroides tópicos foram classificados em sete categorias de potência, em ordem decrescente, com a potência determinada por um ensaio de vasoconstrição [Tabela 1]. Os corticosteroides superpotentes estão incluídos no grupo I. No grupo VII, estão os corticosteroides tópicos fracos vendidos sem prescrição médica.40
_____________________________________________________
Tabela 1. Classificação dos esteroides tópicos usados no tratamento da psoríase, em ordem decrescente de potência
|
Grupo |
Nome genérico |
Nome comercial |
Potência (%) |
|
I |
Dipropionato de betametasona em veículo otimizado |
Diprolene pomada |
0,05 |
|
Propionato de clobetasol |
Temovato creme, pomada |
0,05 | |
|
Diacetato de diflorasona |
Psorcon pomada |
0,05 | |
|
II |
Amcinonida |
Cyclocort pomada |
0,1 |
|
Dipropionato de betametasona, intensificado |
Diprolene AF creme |
0,05 | |
|
Dipropionato de betametasona |
Diprosone pomada |
0,05 | |
|
Furoato de mometasona |
Elocon pomada |
0,1 | |
|
Diacetato de diflorasona |
Florone pomada, Maxiflor pomada |
0,05 | |
|
Halcinonida |
Halog creme |
0,1 | |
|
Fluocinonida |
Lidex creme, pomada; Topsyn gel |
0,05 | |
|
Desoximetasona |
Topicort creme, pomada |
0,25 | |
|
III |
Acetonida de triancinolona |
Aristocort creme (HP) |
0,5 |
|
Dipropionato de betametasona |
Diprosone creme |
0,05 | |
|
Diacetato de diflorasona |
Florone creme, Maxiflor creme |
0,05 | |
|
Valerato de betametasona |
Valisona pomada |
0,1 | |
|
IV |
Acetonida de triancinolona |
Aristocort pomada, Kenalog pomada |
0,1 |
|
Benzoato de betametasona |
Benisona pomada |
0,025 | |
|
Flurandrenolida |
Cordran pomada |
0,05 | |
|
Furoato de mometasona |
Elocon creme |
0,1 | |
|
Acetonida de fluocinolona |
Synalar-HP creme |
0,2 | |
|
Synalar pomada |
0,025 | ||
|
V |
Benzoato de betametasona |
Benisona creme |
0,025 |
|
Flurandrenolida |
Cordran creme |
0,05 | |
|
Propionato de fluticasona |
Cutivato creme |
0,05 | |
|
Dipropionato de betametasona |
Diprosone loção |
0,02 | |
|
Acetonida de triancinolona |
Kenalog creme, loção |
0,1 | |
|
Butirato de hidrocortisona |
Locoid creme |
0,1 | |
|
Acetonida de fluocinolona |
Synalar creme |
0,025 | |
|
Valerato de betametasona |
Valisona creme, loção |
0,1 | |
|
Valerato de hidrocortisona |
Westcort creme |
0,2 | |
|
VI |
Dipropionato de alclometasona |
Aclovato creme |
0,05 |
|
Desonida |
Tridesilon creme, pomada; DesOwen creme, pomada |
0,05 | |
|
Pivalato de flumetasona |
Locorten creme |
0,03 | |
|
Acetonida de fluocinolona |
Synalar solução |
0,01 | |
|
VII |
Hidrocortisona |
Hytone creme, loção, pomada |
2,5 |
|
Hytone, Penecort, Synacort, Cort-Dome, Nutracort |
1 |
______________________________________________________
Efeitos colaterais. Os efeitos colaterais produzidos pelos corticosteroides tópicos observados com mais frequência são as reações cutâneas locais. O desenvolvimento de atrofia cutânea, telangiectasia e estrias irreversíveis são os efeitos colaterais mais comuns. A dermatite perioral, caracterizada pelo aparecimento de pústulas e pápulas eritematosas na face, é causada pelo uso prolongado dos corticosteroides tópicos. A taquifilaxia, com adaptação ao uso dos corticosteroides tópicos e perda da resposta a estes fármacos, é percebida pela maioria dos pacientes. Podem ocorrer ataques ou rebotes de psoríase com a retirada abrupta dos corticosteroides tópicos. Enfim, pode haver supressão do eixo hipotálamo-hipófise-suprarrenal, especialmente com o uso de corticosteroides tópicos superpotentes, aplicação amplamente disseminada de corticosteroides, oclusão ou uso prolongado. Devido à preocupação com os efeitos colaterais, a bula que acompanha a embalagem de alguns corticosteroides superpotentes sugere que a duração do uso seja limitada a 2 semanas. Foram desenvolvidos alguns regimes nos quais, após as primeiras semanas de tratamento contínuo com corticosteroides tópicos superpotentes, as placas psoriáticas são subsequentemente tratadas apenas nos fins de semana.41
Análogos de vitamina D
Calcipotrieno. Primeiro análogo de vitamina D de uso tópico a receber aprovação do FDA para uso nos Estados Unidos, o calcipotrieno rapidamente ganhou aceitação, apesar de não ser tão efetivo quanto os corticosteroides tópicos superpotentes. O calcipotrieno é disponibilizado em forma de pomada, creme e em solução. O motivo primário de seu sucesso é a isenção dos efeitos colaterais produzidos por quaisquer corticosteroides – a saber: atrofia cutânea, telangiectasia, estrias ou supressão do eixo hipotálamo-hipófise-suprarrenal. O calcipotrieno é comparável em termos de eficácia a um corticosteroide pertencente ao grupo II. Deve ser aplicado 2 vezes/dia.
O calcipotrieno tem sido usado com grande sucesso combinado a vários medicamentos. É mais efetivo quando combinado a um corticosteroide tópico superpotente. Um regime à base de calcipotrieno pomada e proprionato de halobetasol pomada, cada qual aplicada 1 vez/dia, foi comprovadamente mais efetivo do que a monoterapia apenas com calcipotrieno (2 vezes/dia) ou com propionato de halobetasol (2 vezes/dia).42 Até 90% dos pacientes alcançam melhoras acentuadas em duas semanas de terapia combinada com uma aplicação diária de pomada calcipotrieno e uma aplicação diária de proprionato de halobetasol pomada. Para a manutenção da remissão por tempo prolongado, foi desenvolvido um regime em que o propionato de halobetasol é aplicado somente nos fins de semana e o calcipotrieno é aplicado nos demais dias da semana.43 Usando este regime, 76% dos pacientes alcançaram melhora acentuada com duração mínima de seis meses. Este nível de melhora foi alcançado apenas por 40% dos pacientes tratados com proprionato de halobetasol pomada somente nos fins de semana. Também foi demonstrado que o calcipotrieno melhora a resposta à luz ultravioleta B (UVB)44 e ao psoraleno + luz ultravioleta A (PUVA).45
É preciso ter cautela ao combinar calcipotrieno pomada a outros medicamentos, devido à facilidade de inativação. O ácido salicílico, por exemplo, inativa completamente o calcipotrieno quando ambos entram em contato. Diversas medicações tópicas, incluindo os corticosteroides tópicos, podem inativar o calcipotrieno. Em contraste, a pomada de proprionato de halobetasol é compatível com o calcipotrieno, mesmo quando um medicamento é aplicado por cima do outro.46 Foi demonstrado que a UVA inativa o calcipotrieno,47 por isso este deve ser aplicado após a terapia com PUVA. O uso de calcipotrieno deve ser limitado a um máximo de 120 g/semana, devido aos relatos isolados de hipercalcemia.48
Um produto contendo uma combinação de calcipotrieno e dipropionato de betametasona atualmente é disponibilizado nos Estados Unidos, Europa e Canadá. Este composto parece ser mais efetivo do que as medicações individuais aplicadas separadamente.49
Outros análogos da vitamina D. Vários novos análogos da vitamina D estão sendo investigados nos Estados Unidos ou já são usados em outros locais. O talcacitol e o maxacalcitol são medicações promissoras para uso no tratamento da psoríase. O único efeito colateral comum é a irritação, que ocorre em até 20% dos pacientes, mais frequentemente na face e nas áreas intertriginosas. O calcitriol tópico é aprovado para uso no tratamento da psoríase em vários países e está pronto para ter o uso aprovado nos Estados Unidos,50 podendo ser menos irritante do que o calcipotrieno nos sítios intertriginosos.
Tazaroteno
O tazaroteno é um retinoide que foi desenvolvido para ser usado no tratamento da psoríase. É disponibilizado em forma de gel (0,05% e 0,1%) e na formulação em creme. O tazaroteno tem eficácia comparável à de um creme corticosteroide de grupo II. Os pacientes que recebem gel de tazaroteno a 0,1% apresentam períodos mais longos de remissão após a descontinuação da terapia, em comparação aos paciente tratados com corticosteroides.
O tazaroteno apresenta diversas vantagens em relação aos corticosteroides. Em primeiro lugar, ele não está associado à atrofia cutânea, à telangiectasia nem ao desenvolvimento de estrias. De fato, assim como outros retinoides, o tazaroteno pode, na verdade, prevenir a atrofia causada pelos corticosteroides. Foi comprovado que o tazaroteno melhora a eficácia da fototerapia com UVB,51 mas também aumenta a capacidade da luz ultravioleta de produzir eritema.52 As doses de UVB e UVA devem, portanto, ser reduzidas para pacientes que também usem tazaroteno.
Efeitos colaterais. O principal efeito colateral do tazaroteno é a irritação local, que leva muitos pacientes a descontinuarem seu uso. A combinação de tazaroteno e corticosteroide tópico ameniza a irritação e melhora a eficácia de ambos os agentes.
Alcatrão
O alcatrão é usado desde o século XIX no tratamento da psoríase. O alcatrão de carvão bruto, que consiste em uma mistura complexa de milhares de compostos hidrocarbonetos, afetaas células epidérmicas psoriáticas via inibição enzimática e ação antimitótica.53 O alcatrão de carvão bruto é sujo para aplicar, tem cheiro forte e mancha tanto a pele como as roupas. É aplicado com a fototerapia UVB no regime de Goeckerman [ver Fototerapia, adiante]. Preparações mais refinadas de alcatrão, que sejam aceitáveis do ponto de vista cosmético, são disponibilizadas com ou sem prescrição médica, nas formulações em gel, creme, óleos de banho, xampu e soluções (liquor carbonis detergens). Com frequência, o alcatrão é usado em terapias combinadas e na terapia de manutenção subsequente à resolução das placas. Apesar das evidências de que a exposição ocupacional ao alcatrão é carcinogênica, não há relatos de aumento da incidência de malignidades cutâneas entre os pacientes com psoríase tratados com fototerapia UVB e alcatrão.54
Antralina
A antralina (ditranol) é usada no tratamento da psoríase desde 1916. É um agente tópico de extrema efetividade no tratamento desta condição, provavelmente por inibir o metabolismo enzimático e diminuir a renovação epidérmica mitótica.55
Indicações. Devido às manchas e irritação associadas ao uso da antralina, este agente geralmente é prescrito para pacientes irresponsivos a outras terapias tópicas.
Formulações e regimes. Um regime modificado combina a aplicação diária de uma pasta firme de antralina a banhos de alcatrão e exposição à luz ultravioleta. Esta terapia envolve a aplicação de concentrações progressivamente maiores de antralina por 6 a 8 horas de cada vez e foi introduzida nos Estados Unidos para pacientes com psoríase internados50 e paciente de ambulatório atendidos em centros de tratamento de psoríase.56
Formulações modificadas de antralina são usadas para minimizar as manchas produzidas pela antralina, diminuir a irritação e possibilitar o uso da medicação em casa. Na terapia de contato rápido, a antralina é aplicada nas placas localizadas e, após 30 minutos a 2 horas, removida completamente para minimizar a irritação da pele circundante.57 A antralina em uma base cremosa, que pode ser removida por lavagem com água, é conveniente para uso em casa. Nesta formulação, a antralina é disponibilizada nas concentrações de 1% e 0,5% para aplicação nas lesões localizadas que surgem na pele e no couro cabeludo.
Atualmente, é disponibilizada uma formulação de antralina em creme a 1%, composta de cristais lipídicos microencapsulados que liberam antralina para ser absorvida sob as condições de temperatura da pele. Ao ser usada como terapia de contato rápido, esta preparação está associada a um baixo risco de manchas e irritação.58
Do ponto de vista terapêutico, a antralina é mais efetiva na forma de pasta firme contendo parafina. Esta forma é mais comumente usada nos centros de tratamento ambulatorial da psoríase. A antralina pomada é menos efetiva do que a pasta de antralina, e a antralina creme é ainda menos efetiva. Com relação à complacência do paciente, esta ordem é inversa. O ponto de término do tratamento é a resolução das placas ao estado macular. Esta resolução em geral está associada à hiperpigmentação pós-inflamatória residual e à produção de manchas temporárias por ação da antralina. É comum o desaparecimento dos sintomas ocorrer em 2 a 3 semanas após um regime de Ingram modificado. As remissões duram semanas a meses.
Efeitos colaterais. As manchas na pele, roupas e partes da casa são comuns quando se usa a antralina, assim como a irritação no sítio de aplicação.
Luz solar
A radiação ultravioleta exerce efeito benefício sobre a psoríase. Tomar banhos de sol por 2 a 4 semanas diminui a morbidade associada ao distúrbio. A climatoterapia realizada no Mar Morto é eficiente como terapia alternativa para pacientes com psoríase que podem viajar para qualquer parte do mundo. Por sua localização geográfica exclusiva, a 300 m abaixo do nível do mar, os pacientes são expostos a uma luz ultravioleta naturalmente filtrada, que resulta em melhora ou resolução completa dos sintomas em 83% dos pacientes, no decorrer de algumas semanas.59 A luz solar na região do Mar Morto contribui para a maior parte da resposta, enquanto o banho no próprio Mar Morto resulta pouco benefício adicional. Não surpreende o fato de os pacientes tratados no Mar Morto apresentarem taxas de incidência mais altas de câncer de pele não melanoma.60
Fototerapia
A fototerapia com UVB é uma importante opção terapêutica para pacientes com psoríase extensiva. A irradiação UVB pode ser usada de modo isolado, mas é tradicionalmente combinada à aplicação tópica de alcatrão. A aplicação intra-hospitalar diária de alcatrão de carvão bruto e a exposição à luz ultravioleta (regime de Goeckerman) podem levar à resolução completa dos sintomas em indivíduos com psoríase amplamente disseminada, em questão de 3 a 4 semanas, além de poderem afetar as remissões, fazendo-as durar semanas a meses.
Em uma reavaliação do regime de Goeckerman, a aplicação de uma preparação de alcatrão a 1% mostrou-se tão efetiva quanto uma preparação a 6%. Além disso, a aplicação da preparação de alcatrão por 2 horas antes da irradiação foi equivalente a períodos mais longos de aplicação.61 As contraindicações ao uso do regime de Goeckerman incluem a existência de psoríase com inflamação e escoriações graves, as formas eritrodérmica e pustular da doença, foliculite e uma história de fotossensibilidade.
Os regimes mais modernos, que são mais convenientes e esteticamente aceitáveis, combinam a UVB ao uso de emolientes. O emoliente ou veículo diminui a reflectância da crosta psoriática e, desta forma, intensifica a transmissão da luz. De acordo com o relato de Lowe et al., os resultados alcançados com os emolientes são equivalentes àqueles obtidos com o alcatrão, quando usados em regimes que empregam doses de UVB suficientes para causar eritema (eritemogênicos). Contudo, o alcatrão pode produzir um efeito adicional ao ser combinado a um regime menos agressivo de UVB suberitemogênico.62
Em um estudo comparativo, a fototerapia com UVB ambulatorial foi administrada 3 vezes/semana, aliada à aplicação de óleo de alcatrão ou emoliente com uma frequência de 2 vezes/dia. Esta abordagem resultou na depuração das lesões psoriáticas em 78% dos pacientes [Figura 10]. Não foram observadas diferenças significativas em termos de resposta ao óleo de alcatrão e ao emoliente.63 Embora o estudo de Lowe tenha mostrado um efeito aditivo do uso combinado de alcatrão e irradiação UVB no momento em que os pacientes foram avaliados, após 3 a 4 semanas (antes da depuração das lesões),64 este estudo comparativo mostrou que tal efeito aditivo estava ausente nos pacientes avaliados no momento em que as lesões foram depuradas. A remissão foi mais duradoura nos pacientes submetidos à fototerapia UVB de manutenção com frequência de 2 vezes/semana, durante 1 a 2 meses e, subsequentemente, 1 vez/semana por até 4 meses, em comparação aos pacientes que pararam de receber fototerapia UVB após a depuração inicial.
_____________________________________________________________
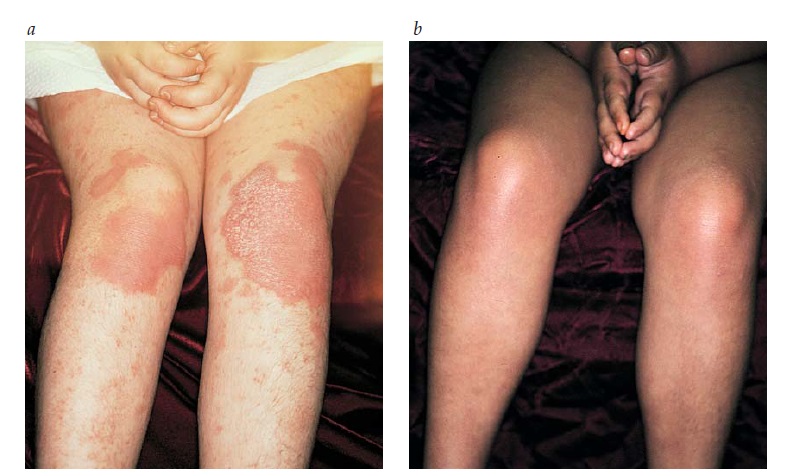
Figura 10. psoríase em uma criança (a) antes e (b) após a fototerapia.
_____________________________________________________________
Luz ultravioleta B (UVB) de banda estreita
A UVB de banda estreita, que abrange comprimentos de onda de aproximadamente 311 nm (em oposição à faixa de 295 a 320 nm da UVB de banda larga), é uma abordagem nova e mais efetiva do que a UVB de banda larga.65 Assim como as outras formas de fototerapia, a UVB de banda estreita atua produzindo efeitos locais e, por isso, as áreas cobertas (p. ex., couro cabeludo) não respondem.66
Fotoquimioterapia
A fotoquimioterapia com PUVA é indicada para pacientes com psoríase extensiva e debilitante, que tenha falhado em responder às formas convencionais de terapia, incluindo a fototerapia com UVB de banda estreita ou convencional. A terapia com PUVA envolve a administração de um fármaco fotossensibilizante chamado metoxisaleno (8-metoxipsoraleno) – de uma dose oral, por imersão em banheira contendo metoxisaleno ou com aplicação tópica de metoxisaleno – seguida da exposição do paciente à luz ultravioleta de comprimento de onda longo e alta intensidade no interior de uma câmara de irradiação com entrada direta. A dose de UVA inicial (em Joules/cm2) é estabelecida com base no tipo de pele do paciente e calculada de acordo com ao protocolos estabelecidos.67
Embora seu efeito terapêutico seja local, a PUVA é um tratamento sistêmico em que o metoxisaleno fotoativado se liga ao DNA epidérmico, formando adutos mono e bifuncionais. Foi postulado que a resultante interferência na mitose epidérmica é um dos mecanismos de ação da terapia com PUVA para psoríase, embora os efeitos sobre a função imune na pele exerçam papel importante.
A eficácia da terapia com PUVA oral foi estabelecida por vários estudos multicêntricos.68 Um curso de terapia com PUVA administrado 2 a 3 vezes/semana resultou em melhora significativa das lesões da psoríase em cerca de 90% dos pacientes, em média com 25 tratamentos totais. Após o curso inicial, um regime de manutenção de afunilamento é instituído e a terapia com PUVA eventualmente é descontinuada. Na maioria dos pacientes, a psoríase reaparece decorridos meses a anos da descontinuação do tratamento com PUVA, indicando que esta é uma terapia paliativa, e não curativa.
Nota do editor: No manejo da psoríase o grande divisor de águas foi a combinação da radiação ultravioleta A com o psoralens chamada de PUVA. O estudo de Melski e colaboradores publicado em 1977 incluiu 1308 pacientes demonstrou desaparecimento das lesões em 88% dos casos e apenas 3% dos pacientes não apresentaram nenhuma melhora, a maioria dos pacientes não apresentaram efeitos colaterais ou efeitos leves, sendo náuseas o mais comum.
Efeitos colaterais
Os efeitos colaterais agudos causados pela fototerapia, como eritema e formação de bolhas, estão relacionados à dose e, portanto, podem ser controlados. O prurido, geralmente associado ao ressecamento da pele, é bastante comum e pode ser aliviado com o uso de emolientes e anti-histamínicos orais. Os pacientes podem ter náusea após ingerirem metoxisaleno. O aspecto mais preocupante deste tratamento refere-se aos potenciais efeitos colaterais a longo prazo, particularmente a carcinogenicidade. Embora o FDA tenha aprovado o uso do PUVA para tratamento da psoríase, é necessário monitorar os pacientes atentamente quanto à ocorrência de efeitos colaterais a longo prazo. Um estudo multicentros, envolvendo mais de 1.300 pacientes tratados com PUVA nos Estados Unidos, que foram avaliados após 1 a 3 anos de seguimento, revelou um aumento significativo do número de casos de carcinoma de células escamosas (CCE) envolvendo pacientes com história de exposição à radiação ionizante ou com história de câncer de pele.69 Uma proporção CCE:epiteliomas de células basais acima do esperado e um excesso de CCE em áreas do corpo não expostas à luz solar foram os achados significativos deste estudo. Um estudo de seguimento de 5,7 anos do grupo da coorte original revelou um aumento dose-dependente do risco de CCE.70 Houve apenas um aumento discreto do risco de carcinoma de células basais, nestes pacientes. O risco de CCE foi quase 13 vezes maior nos pacientes que receberam altas doses cumulativas de PUVA, em comparação ao risco apresentado pelos pacientes submetidos à terapia com doses baixas.
Um estudo de seguimento dos sobreviventes que pertenciam àquela coorte, conduzido em pelo menos 15 anos após o tratamento inicial, avaliou novamente o risco de desenvolvimento de cânceres de pele. Um achado bastante preocupante foi um aumento pequeno (mas estatisticamente significativo) da incidência de meloma maligno.71 Como este aumento somente se tornou evidente após um período mínimo de 15 anos, é bastante preocupante a possibilidade de que altas taxas de incidência de melanoma sejam encontradas entre os pacientes que começaram o tratamento com PUVA há alguns anos. Felizmente, até o momento, isto ainda não foi constatado.
Estudos realizados com animais sugerem que a terapia com PUVA pode produzir efeitos colaterais oculares. O metoxisaleno foi detectado na lente de ratos que haviam ingerido o fármaco. A exposição subsequente à UVA intensifica alterações oculares induzidas pela radiação ultravioleta, como a catarata.72 O risco de toxicidade ocular e o possível dano à retina são particularmente preocupantes em indivíduos jovens, cujas lentes transmitem mais UVA do que as lentes mais opacas dos indivíduos de idade mais avançada, bem como em indivíduos afácicos, que não possuem lentes.73 O uso de óculos opacos que bloqueiam a radiação UVA durante as sessões de tratamento com PUVA é extremamente importante. Os óculos que bloqueiam a radiação UVA devem ser usados desde o momento da administração do metoxisaleno e, então, durante o dia todo. Alguns pesquisadores recomendam o uso de proteção para os olhos no dia seguinte ao da terapia. Até o presente, os estudos sobre pacientes tratados com PUVA não demonstraram nenhum aumento da incidência de catarata.74
Terapia sistêmica
Metotrexato
O uso de curta duração do antimetabólito metotrexato pode ser extremamente efetivo como tratamento da psoríase. O metotrexato é indicado para pacientes que não respondem adequadamente à fototerapia e para aqueles com artrite psoriática.
Antigamente, pensava-se que a fonte da eficácia do metotrexato contra a psoríase era seu efeito antimitótico sobre os queratinócitos proliferantes. Entretanto, estudos que empregaram culturas de tecido sugeriram que as células linfoides ativadas presentes nos linfonodos, sangue e pele são prováveis alvos do metotrexato. Os macrófagos e as células T proliferantes são 100 vezes mais sensíveis ao metotrexato do que as células epiteliais proliferantes.75 Estes achados podem ser relevantes ao mecanismo de ação do metotrexato em outros distúrbios com base imunológica, incluindo a artrite psoriática, artrite reumatoide e doença de Crohn.
Dosagem. A melhor forma de administrar o metotrexato é uma única dose oral de até 30 mg/semana ou 3 doses divididas a intervalos de 12 horas durante um período de 24 horas (p. ex., às 8 h, 20 h e, no dia seguinte, às 8 h).
Hepatotoxicidade e biópsia do fígado. Tem sido defendido o uso da biópsia de fígado para monitoramento de pacientes com psoríase tratados com metotrexato. Contudo, esta recomendação é controversa. Os críticos argumentam que as biópsias hepáticas não são realizadas de modo rotineiro em pacientes com artrite reumatoide sob tratamento com metotrexato.76 Mesmo assim, uma revisão da literatura mostra claramente que os pacientes com psoríase tratados com metotrexato são mais propensos a desenvolver fibrose hepática, possivelmente por causa da doença subjacente ou de outros tratamentos concomitantes.
As atuais diretrizes recomendam o uso da biópsia de fígado para casos de pacientes com psoríase que receberam uma dose cumulativa de 1 a 1,5 g de metotrexato e não possuem história de doença hepática nem de alcoolismo. A biópsia deve ser realizada ainda no início do curso do tratamento de pacientes com história de hepatite C, alcoolismo ou outra doença hepática. Outros fatores de risco de hepatotoxicidade são a obesidade e o diabetes.77
As alterações hepáticas patológicas causadas pela terapia com metotrexato foram graduadas do seguinte modo: grau I, histologia hepática normal ou infiltração gordurosa discreta; grau II, infiltração gordurosa moderada a grave, com inflamação do trato portal e necrose; grau IIIA, fibrose discreta; grau IIIB, fibrose moderada a grave; e grau IV, cirrose. O metotrexato deve ser descontinuado em pacientes com alterações hepáticas patológicas de grau IIIB ou IV. A importância de uma rigorosa aderência às diretrizes vigentes para administração do metotrexato é enfatizada pelos casos de cirrose induzida por este fármaco com necessidade de transplante de fígado em três pacientes com psoríase de longa duração, que não foram submetidos a exames de biópsias hepáticas seriadas.78 Pesquisas realizadas na Europa demonstraram que a biópsia hepática é desnecessária em casos de pacientes com níveis normais de amino-pró-peptídeo de pró-colágeno III, um marcador de fibrose.79
Outros efeitos colaterais. Além da hepatotoxicidade, outros efeitos colaterais da terapia à base de metotrexato incluem a supressão da medula óssea, náusea, diarreia e estomatite. O metotrexato é teratogênico e pode causar oligospermia reversível. A pneumonite pode ocorrer no início do curso do tratamento, caso o metotrexato seja administrado em doses oncológicas. A avaliação por meio de testes de função hepática, função renal e elementos do sangue deve ser realizada antes e ao longo de todo o curso da terapia com metotrexato.
Nota do editor: ao contrario da hepatite por metotrexate, que só ocorre após certa quantidade da droga ser ingerida, a pneumonite por metotrexate é uma reação idiossincrática e muitas vezes imprevisível.
Como o metotrexato inibe a absorção do ácido fólico, o uso de suplementos de folato é recomendado com frequência para pacientes que recebem metotrexato para tratamento de condições não cancerosas. Esta suplementação pode diminuir a incidência de alguns efeitos colaterais, em especial da hepatotoxicidade e da intolerância gastrintestinal, sem comprometer a eficácia do metotrexato.80
Certos fármacos aumentam a toxicidade do metotrexato ao diminuírem a secreção tubular renal. Estes fármacos incluem os salicilatos, sulfonamidas, probenecida e penicilinas. Outros fármacos intensificam a toxicidade deslocando o metotrexato de seus sítios de ligação nas proteínas plasmáticas. Entre estes fármacos, estão os salicilatos, probenecida, barbitúricos e fenitoína. Muitos AINH e a trimetoprima-sulfametoxazol intensificam a toxicidade do metotrexato.76 Os casos de pancitopenia subsequente à terapia com doses baixas de metotrexato subestimam os perigos associados ao uso deste fármaco por pacientes com insuficiência renal ou sob tratamento concomitante com fármacos que aumentam a toxicidade do metotrexato.81
As contraindicações ao tratamento com metotrexato e as indicações para suspensão deste tratamento devem ser respeitadas. O acompanhamento médico constante é necessário, sendo que a terapia deve ser descontinuada se o paciente desenvolver toxicidade.
Acitretina
Indicações e dosagem. A acitretina, um retinoide oral, foi aprovada pelo FDA para ser usada no tratamento da psoríase em placas. É altamente efetiva no tratamento da psoríase pustular e pode ser muito efetiva como monoterapia para a psoríase eritrodérmica. No entanto, para a psoríase em placas e psoríase em gotas, a acitretina é mais útil quando combinada a outros tratamentos, em particular a fototerapia com UVB e PUVA.82,83 A acitretina é iniciada em 1 a 2 semanas antes do início da terapia com UVB ou PUVA. Com o tratamento combinado, a resolução dos sintomas é bem mais rápida. Doses de apenas 10 a 25 mg/dia são efetivas e, portanto, minimizam os efeitos colaterais do retinoide.82,83 Usada como monoterapia, a acitretina é prescrita em doses de 25 mg/dia, que podem ser aumentadas para 50 mg/dia ou mais.
Efeitos colaterais. Os efeitos colaterais da acitretina estão relacionados com a dose e são comuns com o uso de dosagens acima de 25 mg/dia. Entre os efeitos adversos mucocutâneos, estão a perda de cabelo, queilite, descamação das palmas das mãos e solas dos pés, sensibilidade à luz solar e granulomas piogênicos peringueais. A hiperlipidemia é comum, mas pode ser facilmente controlada com drogas hipolipemiantes. Pode haver elevações dos níveis de enzimas hepáticas, e os níveis enzimáticos devem ser monitorados. A obtenção de biópsias hepáticas seriadas não demonstrou a ocorrência de fibrose hepática em pacientes tratados com retinoides orais.84
A acitretina impõe um risco significativo de teratogenicidade. Os defeitos inatos característicos do uso de retinoides são encontrados em uma alta proporção de fetos expostos in utero até mesmo a pequenas quantidades do fármaco. A acitretina é eliminada do corpo bem mais rapidamente do que seu pró-fármaco, o etretinato. Em presença de álcool, porém, a acitretina é reconvertida em etretinato.85 Isto gera preocupação com a possibilidade de as mulheres em idade fértil que tomam acitretina e engravidam posteriormente apresentarem risco de exposição fetal aos efeitos teratogênicos da acitretina. Por este motivo, o FDA exige que a acitretina não seja administrada em mulheres que planejam engravidar em um período de três anos.
Os efeitos colaterais a longo prazo dos retinoides orais incluem a calcificação dos ligamentos e tendões, e a osteoporose.86,87 A segurança a longo prazo do etretinato (o pró-fármaco da acitretina) foi investigada em um estudo prospectivo de 5 anos de duração, que envolveu 956 pacientes com psoríase. Os pesquisadores concluíram que, com a seleção e monitoramento adequados dos pacientes, não há risco substancialmente aumentado de efeitos colaterais relacionados ao desenvolvimento de doença cardiovascular, câncer, diabetes, catarata e enteropatia inflamatória. Apesar da melhora dos sintomas articulares de alguns pacientes, um número maior de pacientes apresentaram problemas articulares associados ao etretinato. O etretinato também causou alterações a curto prazo nos níveis de enzimas hepáticas de alguns pacientes e, em casos raros, hepatite aguda. O risco a longo prazo de desenvolvimento de doença hepática e cirrose associado ao etretinato, porém, foi menor do que o risco associado ao uso do metotrexato por períodos comparáveis.88
Ciclosporina
A ciclosporina na formulação em microemulsão foi aprovada pelo FDA para uso no tratamento da psoríase, após uma extensiva experiência de abrangência internacional. Na dosagem de 2,5 a 5 mg/kg/dia, a ciclosporina é altamente efetiva para tratamento da psoríase. Entretanto, mesmo quando usada nestas doses, pode estar associada a efeitos colaterais significativos, e isto tem limitado seu uso por pacientes com doença grave ou refratária.
Indicações e dosagem. A ciclosporina é indicada para pacientes nos quais a fototerapia ou a terapia com metotrexato tenha falhado. A formulação em microemulsão da ciclosporina é mais bem absorvida do que as formulações antigas e é disponibilizada em cápsulas de gel contendo 25 e 100 mg, que são mais comumente tomadas em doses divididas, 2 vezes/dia. Na dosagem de 5 mg/kg/dia, a maioria dos pacientes responde em 4 semanas, sendo que alguns chegam a responder em 1 semana. É preciso notar que, nos Estados Unidos, a bula que acompanha a embalagem da ciclosporina recomenda um limite de dosagem máximo de 4 mg/kg/dia, embora a experiência internacional acerca da eficácia e segurança deste fármaco estabeleça um limite de dosagem máximo de 5 mg/kg/dia.89 Nos Estados Unidos, a duração máxima do tratamento com ciclosporina aprovada pelo FDA é 1 ano.
Efeitos colaterais. A ciclosporina está associada a alguns efeitos colaterais que podem ser facilmente controlados e a outros mais preocupantes. Pode haver hipertricose, tremores, parestesias, cefaleia, hiperplasia gengival, dor articular e fadiga. Elevações dos níveis séricos de lipídios e aumentos discretos dos níveis de enzimas hepáticas são igualmente comuns. A hipomagnesemia pode requerer suplementação de magnésio. Os efeitos colaterais comuns mais sérios são a hipertensão e a nefrotoxicidade. A hipertensão pode ser controlada com a diminuição da dose ou instituição de tratamento à base de bloqueadores de canais de cálcio (p. ex., besilato de amlodipina). Há evidências de que, nos pacientes normotensos tratados com ciclosporina, a terapia com amlodipina pode prevenir um pouco da nefrotoxicidade associada a este potente tratamento da psoríase.90
A fibrose intersticial renal e a atrofia tubular renal são comuns em pacientes sob terapia prolongada com ciclosporina.91,92 Em consequência, os níveis séricos de creatinina devem ser monitorados regularmente. Se os níveis séricos de creatinina sofrerem um aumento superior a 30% dos níveis basais (ou acima de 25%, de acordo com a bula da ciclosporina comercializada nos Estados Unidos), é possível que a dose tenha de ser diminuída.89
Entre os pacientes receptores de transplante de órgão que tomam ciclosporina, entre outros fármacos imunossupressores, para prevenção da rejeição, a incidência de doenças linfoproliferativas e cânceres de pele é maior.93,94 Espera-se que, futuramente, a administração de doses menores e o uso intermitente da ciclosporina pelos pacientes com psoríase não estejam associados um aumento da incidência de malignidades. Entretanto, é preciso ter cautela. Em um estudo, nenhum aumento na incidência de distúrbios linfoproliferativos foi observado entre os pacientes com artrite reumatoide tratados com ciclosporina por curtos períodos (em média 1,6 ano), em comparação a um grupo paralelo de pacientes reumáticos não tratados com ciclosporina.95 Mesmo assim, é preciso ter cautela ao usar este novo e poderoso tratamento para psoríase.
Tacrolimus
Embora o tacrolimus não tenha sido aprovado pelo FDA para uso em casos de psoríase, é um agente imunossupressor potente que pode substituir a ciclosporina no tratamento de pacientes intolerantes à hipertricose associada a este agente. O tacrolimus é comprovadamente efetivo no tratamento da psoríase. Em um estudo duplo-cego, 50 pacientes com psoríase recalcitrante grave receberam placebo ou tacrolimus por via oral.96 No grupo tratado com tacrolimus, as doses iniciais foram 0,5 mg/kg/dia e, caso a resposta apresentada pelos pacientes fosse considerada insuficiente, as dosagens podiam ser aumentadas para 0,10/kg na 3ª ou 6ª semana. Decorridas nove semanas de tratamento, os pacientes que receberam tacrolimus apresentaram diminuição de 84% na pontuação do Psoriasis Area and Severity Index (PASI).
Assim como com a ciclosporina, existem aspectos preocupantes relacionados à hipertensão, nefrotoxicidade e efeitos imunossupressores decorrentes do uso do tacrolimus. Este fármaco não está associado à hipertricose nem à hiperplasia gengival. O tacrolimus não foi tão extensivamente estudado quanto a ciclosporina no tratamento da psoríase, e investigações adicionais sobre este agente antipsoríase altamente efetivo se fazem necessárias.
Hidroxiureia
A hidroxiureia pode ser considerada para uso no tratamento da psoríase em casos de pacientes com doença hepática, uma vez que este agente não costuma estar associado à hepatotoxicidade.97 Contudo, a resposta é mais lenta e menos completa do que a resposta ao metotrexato, e o desenvolvimento de resistência à hidroxiureia pode ocorrer com maior frequência. A hidroxiureia é administrada por via oral, a uma dosagem de 1 a 2 g/dia. O monitoramento atento das contagens sanguíneas é necessário no decorrer da terapia.
Sulfassalazina
A sulfassalazina não tem a aprovação do FDA para uso no tratamento da psoríase, mas é altamente efetiva em pacientes selecionados. É tipicamente administrada em doses de 3 a 4 g/dia. Em um estudo, mais de 25% dos pacientes tratados com sulfassalazina pararam o tratamento por causa dos efeitos colaterais (erupções cutâneas ou náusea). Na prática clínica, os resultados obtidos são menos promissores do que os resultados demonstrados pelos estudos.96
Terapia combinada
A combinação de vários tratamentos de psoríase tem eficácia comprovadamente superior à monoterapia. A acitretina é usada de forma rotineira com UVB e PUVA, em uma combinação que permite a administração de doses menores e minimiza as toxicidades associadas tanto à terapia com retinoides como à fototerapia.82,83 A combinação de metotrexato com acitretina tem sido usada com sucesso, apesar de alguns aspectos preocupantes relacionados à hepatotoxicidade de ambos os fármacos.99 É essencial monitorar atentamente os níveis de enzimas hepáticas. O metotrexato e a ciclosporina podem ser usados juntos, sendo que a administração concomitante de ambos em doses pequenas pode resultar em maior eficácia e menos toxicidade, em comparação ao observado com a administração de doses maiores de cada um destes agentes isolados.100 O metotrexato também é usado com bastante sucesso combinado à UVB101 e à PUVA,102 embora existam algumas preocupações com a possibilidade de o metotrexato potencializar o efeito carcinogênico da PUVA.103 Por ter sido associada ao desenvolvimento de cânceres de pele, a ciclosporina não é combinada rotineiramente à PUVA. A ciclosporina pode ser combinada aos retinoides e ao micofenolato de mofetil.
Outras terapias sistêmicas
O micofenolato de mofetil, um fármaco aprovado pelo FDA para uso na prevenção à rejeição de órgãos transplantados, é altamente efetivo para alguns pacientes com psoríase.104 O micofenolato de mofetil é o pró-fármaco do ácido micofenólico, uma medicação testada na psoríase durante os anos 1970.105 Embora o ácido micofenólico tenha alta eficácia comprovada no tratamento da psoríase, seus efeitos colaterais fizeram com que os fabricantes não buscassem a aprovação do FDA para esta indicação. Entre estes efeitos colaterais, estão a toxicidade gastrintestinal e um efeito imunossupressor que resultou em infecção por herpes-zóster em mais de 10% dos pacientes tratados.
A 6-tioguanida é outro agente quimioterápico anticâncer altamente efetivo contra a psoríase. Contudo, seu uso está associado à supressão da medula óssea em cerca de 50% dos pacientes.106 A toxicidade produzida pela 6-tioguanida na medula óssea pode ser reduzida se o fármaco for administrado 2 a 3 vezes/semana, em vez de diariamente.107
Bioterapias
A capacidade de criar moléculas dirigidas contra etapas-alvo específicas da patogênese da psoríase tem levado ao desenvolvimento de agentes biológicos que podem tratar a psoríase sem causar a nefrotoxicidade associada ao uso da ciclosporina nem as toxicidades produzidas pelo metotrexato na medula óssea e no fígado. Os agentes biológicos são imunossupressores, e sua toxicidade a longo prazo é desconhecida. Assim como para outros agentes imunossupressores, existe a preocupação com o potencial de predisposição dos pacientes a infecções ou malignidades. Diversos agentes biológicos têm aprovação do FDA para uso na psoríase – a saber: alefacept, efalizumabe, etanercepte e infliximabe. Outro agente, adalimumabe, foi aprovado para uso na artrite psoriática e em outras doenças, mas ainda está em fase de estudo clínico para uso na psoríase. Outros agentes, como o onercepte (bloqueador de TNF-alfa), um agente anti-IL-12 e um agente anti-IL-23, estão passando por estágios mais iniciais de desenvolvimento.
Alefacept. O alefacept é uma proteína de fusão, que consiste em LFA-3 fundido à porção Fc de IgG1 humana. A porção LFA-3 da molécula liga-se a um receptor de ocorrência natural (CD2) na superfície da célula T em repouso e bloqueia a ativação desta célula. A porção Fc da molécula liga-se aos receptores de Fc existentes nas células natural killer e em macrófagos, com consequente apoptose da célula T ligada.108
O alefacept originalmente recebeu aprovação do FDA para uso como formulações intravenosas e intramusculares, entretanto a forma intramuscular é a única disponibilizada atualmente. O alefacept é administrado em doses semanais de 15 mg, por um período de 12 semanas. Em um estudo, decorridas cerca de 14 semanas do início do tratamento, 21% dos pacientes alcançaram PASI 75 (diminuição de 75% da doença em relação ao basal) e 42% dos pacientes alcançaram PASI 50 (diminuição de 50% da doença em relação ao basal). A melhora tipicamente progride após a conclusão do tratamento, com a redução máxima da doença ocorrendo em 8 semanas após um segundo curso de terapia. Em um estudo, 33% dos pacientes alcançaram PASI 75 e 57% atingiram PASI 50 após este período.109 O benefício mais significativo da terapia com alefacept é a duração prolongada da remissão alcançada por um subgrupo de pacientes. Entre os pacientes que alcançaram PASI 75, a média do tempo decorrido até a recidiva da psoríase (definida pela manutenção do PASI 50) foi de 7 meses após um único curso terapêutico de 12 semanas, e de mais de um ano após dois cursos de terapia.110
As desvantagens da terapia com alefacept incluem o custo elevado do fármaco e a necessidade de monitorar as contagens de células T CD4+, pois o fármaco tende a diminuir o número destas células. O aparecimento da ação do alefacept é lento, e muitos pacientes alcançam a resposta máxima decorridas várias semanas da conclusão do curso de 12 semanas. Além disso, apenas uma parcela dos pacientes alcança uma resposta satisfatória.
Efalizumabe. O efalizumabe é um anticorpo monoclonal humanizado dirigido contra a porção CD11a o LFA-1. O efalizumabe bloqueia a interação entre o LFA-1 e ICAM-1, responsável pela ativação da célula T e trânsito das células T no interior da pele inflamada. Após receberem uma dose de condicionamento de 0,7 mg/kg na primeira semana, os pacientes passam a autoadministrar semanalmente injeções subcutâneas de efalizumabe (1 mg/kg). Em estudos duplo-cego e controlados com placebo, 22 a 39% dos pacientes tratados semanalmente com efalizumabe por 12 semanas alcançaram PASI 75 e quase 60% dos pacientes atingiram PASI 50.111-113 Com uma terapia mais longa, proporções mais altas de pacientes alcançaram graus maiores de melhora. Assim como outros agentes biológicos, o efalizumabe não causa nefrotoxicidade associada ao uso de ciclosporina nem toxicidade junto à medula óssea ou fígado associada ao uso do metotrexato. O fármaco é bastante caro, porém, e os pacientes podem desenvolver sintomas semelhantes aos da gripe após a primeira ou segunda injeção. Uma preocupação séria é o desenvolvimento de rebote de psoríase (definido como piora da psoríase em relação ao basal), que ocorre em até 15% dos pacientes. Para evitar o rebote da psoríase, o efalizumabe não deve ser descontinuado de modo abrupto, e sim convertido lentamente em terapias alternativas.
Etanercepte. O etanercepte é uma proteína de fusão recombinante que inclui o receptor de TNF p75. Este receptor liga-se ao TNF-alfa e bloqueia sua interação com receptores de superfície celular. O etanercepte originalmente recebeu aprovação do FDA para ser usado no tratamento da artrite psoriática em doses de 25 mg autoadministradas por via subcutânea pelo próprio paciente, em sua casa e com uma frequência de 2 vezes/semana. Posteriormente, o etanercepte recebeu aprovação para uso no tratamento da psoríase em doses de 50 mg administradas por via subcutânea 2 vezes/semana, durante 3 meses e, então, 1 vez/semana. Em um estudo duplo-cego controlado por placebo e constituído por 4 ramos que comparou três regimes de doses, a análise do tratamento após 12 semanas mostrou que o PASI 75 foi alcançado por 14% dos pacientes tratados com uma dose semanal de 25 mg, 34% dos pacientes tratados com duas doses semanais de 25 mg, e 49% dos pacientes tratados com duas doses semanais de 50 mg. Os índices de resposta foram ainda mais altos em 24 semanas de tratamento.114
Entre as desvantagens do etanercepte, estão o custo elevado e a necessidade de autoinjetar a medicação por tempo prolongado. As reações no sítio de injeção, embora comuns, quase sempre são mínimas e raramente requerem qualquer tipo de tratamento além do uso temporário de um sítio de injeção diferente. Diante das evidências de que os bloqueadores de TNF-alfa podem exacerbar a esclerose múltipla, torna-se necessário evitar o uso deste etanercepte por pacientes com história pessoal ou familiar de doença desmielinizante. Há controvérsias quanto à possibilidade de os bloqueadores de TNF-alfa exacerbarem a insuficiência cardíaca crônica. Preocupa o fato de os efeitos imunossupressores destes fármacos poderem contribuir para o aumento do desenvolvimento de doenças linfoproliferativas.115 Também há formação de anticorpos antinucleares em pacientes tratados com etanercepte, porém a importância fisiológica destes anticorpos é questionável.
Infliximabe. O infliximabe é um anticorpo monoclonal quimérico dirigido contra o TNF-alfa. A curto prazo (12 semanas), é o tratamento mais efetivo contra a psoríase. É administrado por infusão intravenosa lenta no momento basal, na 2ª e 6ª semanas, e, subsequentemente, a cada 8 semanas. Em um estudo duplo-cego controlado com placebo, que avaliou os pacientes na 10ª semana, após a administração de apenas três infusões, 82% dos pacientes alcançaram o PASI 75.116 Além disso, 55% dos pacientes mantiveram o PASI 50 ou escores mais altos ao longo dos 6 meses de seguimento.
Assim como outros bloqueadores de TNF-alfa, o infliximabe está associado à piora da esclerose múltipla. Há, ainda, a preocupação com a possibilidade de este fármaco predispor ao desenvolvimento de infecções oportunistas ou doenças linfoproliferativas. Um estudo-piloto sobre o uso do infliximabe como possível terapia para insuficiência cardíaca mostrou que, na verdade, doses altas (10 mg/kg) do fármaco estavam associadas à piora da condição em alguns pacientes.117 Além disso, houve desenvolvimento de reações infusionais em uma proporção significativa dos pacientes. Isto parece estar relacionado ao desenvolvimento de anticorpos antiquiméricos humanos. Embora as reações infusionais sejam brandas na maioria dos pacientes, também há casos de reações graves à infusão. O pré-tratamento dos pacientes com analgésicos e anti-histamínicos é benéfico. O bloqueio do TNF-alfa exerce papel significativo no controle da infecção micobacteriana, e foi observado um aumento significativo da reativação da tuberculose latente, extrapulmonar em muitos caos, em pacientes tratados com infliximabe. Em consequência, antes de receberem esta medicação, os pacientes devem ser submetidos ao teste de tuberculose.
Adalimumabe. O adalimumabe é um anticorpo monoclonal totalmente humano, dirigido contra o TNF-alfa. Seu uso foi aprovado pelo FDA para tratamento da artrite reumatoide e da artrite psoriática. O adalimumabe obteve êxito nos testes para uso na psoríase.119 Assim como os demais agentes biológicos, o adalimumabe não é tóxico para os rins, fígado ou medula óssea. Entretanto, do mesmo que os outros bioagentes, seu custo é bastante alto. As mesmas preocupações relacionadas à insuficiência cardíaca, esclerose múltipla e doenças linfoproliferativas associadas ao uso do etanercepte e infliximabe também são descritas na bula que acompanha a embalagem do adalimumabe. Em um estudo controlado com placebo e constituído por 3 grupos, o PASI 75 foi alcançado por 53% dos pacientes tratados com adalimumabe em semanas alternadas e por 80% dos pacientes que receberam o fármaco semanalmente. Um número ainda maior de pacientes alcançou o PASI 50. A dose de 40 mg de adalimumabe é administrada por injeção subcutânea.
Agentes mais novos. O ustekinumabe é um anticorpo monoclonal humano novo, dirigido contra o componente p40 da IL-12 e da IL-23. Em um estudo clínico sobre intervalo de doses, 52% dos pacientes que receberam uma única injeção de 45 mg ustekinumabe alcançaram PASI 75. Dentre os pacientes tratados com 4 doses de 90 mg semanais, 81% alcançaram PASI 75.2 Outro anticorpo monoclonal humano dirigido contra a IL-12 e IL-23, o ABT-874, também promoveu melhora drástica da psoríase.
Prognóstico
A psoríase, que geralmente persiste por toda a vida, pode ter gravidade variável. Alguns pacientes podem apresentar exacerbações periódicas ou remissões relativas da doença. Embora a psoríase pustular e a psoríase eritrodérmica possam ser prejudiciais à vida, até mesmo a psoríase em placas estável pode exercer impacto negativo sobre a condição de saúde geral, possivelmente devido à existência de comorbidades, como a artrite psoriática ou obesidade, ou, ainda, por causa de complicações da terapia.
A exacerbação grave da psoríase cobra pela ingenuidade até mesmo do clínico mais habilidoso. Felizmente, devido à ampla gama de terapias para psoríase disponíveis nos dias de hoje, os clínicos conseguem tratar com sucesso quase todos os pacientes com psoríase. A meta da terapia deve ser a minimização da toxicidade e, ao mesmo tempo, a obtenção de melhora satisfatória tanto dos sinais e sintomas físicos como da qualidade de vida do paciente.
___________________________________________________________________________
Elizabeth A. Abel, MD, atua como pesquisadora ou consultora junto às empresas Abbott Laboratories; Allux Medical, Inc.; Amgen, Inc.; Astellas Pharma, Inc.; Genentech, Inc.; e Novartis AG.
Mark Lebwohl, MD, atua como pesquisador, consultor ou conferencista junto às empresas Abbott Laboratories, Amgen, Inc.; Astellas, Inc.; Centocor, Inc.; Galderma Laboratories; Genentech, Inc.; Novartis AG; Stiefel, Inc.; e Warner Chilcott.
__________________________________________________________________________
Referências
1. Stern RS, Nijsten T, Feldman SR, et al: Psoriasis is common, carries a substantial burden even when not extensive, and is associated with widespread treatment dissatisfaction. J Invest Dermatol Symp Proc 9:136, 2004
2. Koo J: Population-based epidemiologic study of psoriasis with emphasis on quality of life assessment. Dermatol Clin 14:485, 1996
3. Farber EM, Nall ML: The natural history of psoriasis in 5,600 patients. Dermatologica 148:1, 1974
4. Gottlieb SL, Gilleaudeau P, Johnson R, et al: Response of psoriasis to a lymphocyte-selective toxin (DAB389IL-2) suggests a primary immune, but not keratinocyte, pathogenic basis. Nat Med 1:442, 1995
5. Bagel J, Garland WT, Breneman D, et al: Administration of DAB389IL-2 to patients with recalcitrant psoriasis: a double-blind, phase II multicenter trial. J Am Acad Dermatol 38:938, 1998
6. Abrams JR, Lebwohl MG, Guzzo CA, et al: CTLA4Ig-mediated blockage of T-cell costimulation in patients with psoriasis vulgaris. J Clin Invest 103:1243, 1999
7. Griffiths CE: T-cell-targeted biologicals for psoriasis. Curr Drug Targets Inflamm Allergy 3:157, 2004
8. Lebwohl M, Tyring SK, Hamilton TK, et al: A novel targeted T-cell modulator, efalizumab, for plaque psoriasis. Efalizumab Study Group. N Engl J Med 349:2004, 2003
9. Lebwohl M, Christophers E, Langley R, et al: An international, randomized, double-blind, placebo-controlled phase 3 trial of intramuscular alefacept in patients with chronic plaque psoriasis. Alefacept Clinical Study Group. Arch Dermatol 139:719, 2003
10. Victor FC, Gottlieb AB, Menter A: Changing paradigms in dermatology: tumor necrosis factor alpha (TNF-alpha) blockade in psoriasis and psoriatic arthritis. Clin Dermatol 21:392, 2003
11. Sabat R, Philipp S, Hoflich C, et al: Immunopathogenesis of psoriasis. Exp Dermatol 16:779, 2007
12. Krueger GG, Langley RG, Leonardi C, et al: A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis. CNTO 1275 Psoriasis Study Group.N Engl J Med 356:580, 2007
13. Farber EM, Nall ML, Watson W: Natural history of psoriasis in 61 twin pairs. Arch Dermatol 109:207, 1974
14. Capon F, Trembath RC, Barker JN: An update on the genetics of psoriasis. Dermatol Clin 22:339, 2004
15. Helms C, Cao L, Krueger JG, et al: A putative RUNX1 binding site variant between SLC9A3R1 and NAT9 is associated with susceptibility to psoriasis. Nat Genet 35:349, 2003
16. Speckman RA, Wright Daw JA, Helms C, et al: Novel immunoglobulin superfamily gene cluster, mapping to a region of human chromosome 17q25, linked to psoriasis susceptibility. Hum Genet 112:34, 2003
17. Capon F, Di Meglio P, Szaub J, et al: Sequence variants in the genes for the interleukin-23 receptor (IL23R) and its ligand (IL12B) confer protection against psoriasis. Hum Genet 122:201, 2007
18. Cargill M, Schrodi SJ, Chang M, et al: A large-scale genetic association study confirms IL12B and leads to the identification of IL23R as psoriasis-risk genes. Am J Hum Genet 80:273, 2007
19. Lebwohl M, Tan MH: Psoriasis and stress. Lancet 351:82, 1998
20. Gaston L, Lassonde M, Bernier-Buzzanga J, et al: Psoriasis and stress: a prospective study. J Am Acad Dermatol 17:82, 1987
21. Rapp SR, Feldman SR, Exum ML, et al: Psoriasis causes as much disability as other major medical diseases. J Am Acad Dermatol 41:401, 1999
22. Telfer NR, Chalmers RG, Whale K, et al: The role of streptococcal infection in the initiation of guttate psoriasis. Arch Dermatol 128:39, 1992
23. Owen CM, Chalmers RJ, O’Sullivan T, et al: A systematic review of antistreptococcal interventions for guttate and chronic plaque psoriasis. Br J Dermatol 145:886, 2001
24. Polat M, Lenk N, Yalcin B, et al: Efficacy of erythromycin for psoriasis vulgaris. Clin Exp Dermatol 32:295, 2007
25. Obuch ML, Maurer TA, Becker B, et al: Psoriasis and human immunodeficiency virus infection. J Am Acad Dermatol 27:667, 1992
26. Abel EA: Diagnosis of drug-induced psoriasis. Semin Dermatol 11:269, 1992
27. Krueger GG: Psoriasis: current concepts of its etiology and pathogenesis. Yearbook of Dermatology. Dobson RL, Thiers BH, Eds. Year Book Medical Publishers, Chicago, 1982, p 13
28. Katayama H, Kawada A: Exacerbation of psoriasis induced by indomethacin. J Dermatol (Tokyo) 8:323, 1981
29. Magliocco MA, Gottlieb AB: Etanercept therapy for patients with psoriatic arthritis and concurrent hepatitis C virus infection: report of 3 cases. J Am Acad Dermatol 51:580, 2004
30. Passarini B, Infusino SD, Barbieri E, et al: Cutaneous manifestations in inflammatory bowel diseases: eight cases of psoriasis induced by anti–tumor-necrosis-factor antibody therapy. Dermatology 215:295, 2007
31. de Gannes GC, Ghoreishi M, Pope J, et al: Psoriasis and pustular dermatitis triggered by TNF-á inhibitors in patients with rheumatologic conditions. Arch Dermatol 143:223, 2007
32. Gupta MA, Gupta AK, Watteel GN: Cigarette smoking in men may be a risk factor for increased severity of psoriasis of the extremities. Br J Dermatol 135:859, 1996
33. Naldi L, Peli L, Parazzini F: Association of early-stage psoriasis with smoking and male alcohol consumption: evidence from an Italian case-control study. Arch Dermatol 135:1479, 1999
34. Naldi L, Parazzini F, Peli L, et al: Dietary factors and the risk of psoriasis: results of an Italian case control study. Br J Dermatol 134:101, 1996
35. Green MS, Prystowsky JH, Cohen SR, et al: Infectious complications of erythrodermic psoriasis. J Am Acad Dermatol 34:911, 1996
36. Calvert HT, Smith MA, Wells RS: Psoriasis and the nails. Br J Dermatol 75:415, 1963
37. Mease PJ: Recent advances in the management of psoriatic arthritis. Curr Opin Rheumatol 16:366, 2004
38. Gladman DD, Hing EN, Schentag CT, et al: Remission in psoriatic arthritis. J Rheumatol 28:1045, 2001
39. Feldman SR, Fleischer AB, Cooper Ji New topical treatments change the pattern of treatment of psoriasis: dermatologists remain the primary providers of this care. Int J Dermatol 39:41, 2000
40. Cornell RC, Stoughton RB: Correlation of the vasoconstriction assay and clinical activity in psoriasis. Arch Dermatol 121:63, 1985
41. Katz HI, Prawer SE, Medansky RS, et al: Intermittent corticosteroid maintenance treatment of psoriasis: a double-blind multicenter trial of augmented betamethasone dipropionate ointment in a pulse dose treatment regimen. Dermatologica 183:269, 1991
42. Lebwohl M, Siskin SB, Epinette W, et al: A multicenter trial of calcipotriene ointment and halobetasol ointment to either agent alone for the treatment of psoriasis. J Am Acad Dermatol 35:268, 1996
43. Lebwohl M, Yoles A, Lombardi K, et al: Calcipotriene ointment and halobetasol ointment in the long-term treatment of psoriasis: effects on the duration of improvement. J Am Acad Dermatol 39:447, 1998
44. Ramsay CA, Schwartz BE, Lowson D, et al: Calcipotriol cream combined with twice weekly broad-band UVB phototherapy: a safe, effective and UVB-sparing antipsoriatric combination treatment. The Canadian Calcipotriol and UVB Study Group. Dermatology 200:17, 2000
45. Speight EL, Farr PM: Calcipotriol improves the response of psoriasis to PUVA. Br J Dermatol 130:79, 1994
46. Patel B, Siskin S, Krazmien BA, et al: Compatibility of calcipotriene with other topical medications. J Am Acad Dermatol 38:1010, 1998
47. Lebwohl M, Hecker D, Martinez J, et al: Interactions between calcipotriene and ultraviolet light. J Am Acad Dermatol 37:93, 1997
48. Georgiou S, Tsambaos D: Hypercalcaemia and hypercalciuria after topical treatment of psoriasis with excessive amounts of calcipotriol Acta Derm Venereol 79:86, 1999
49. Guenther LC: Fixed-dose combination therapy for psoriasis. Am J Clin Dermatol 5:71, 2004
50. Franssen ME, de Jongh GJ, van Erp PE, et al: A left/right comparison of twice-daily calcipotriol ointment and calcitriol ointment in patients with psoriasis: the effect on keratinocyte subpopulations. Acta Derm Venereol 84:195, 2004
51. Koo JY: Tazarotene in combination with phototherapy. J Am Acad Dermatol 39:S144, 1998
52. Hecker D, Worsley J, Yueh G, et al: Interactions between tazarotene and ultraviolet light. J Am Acad Dermatol 41:927, 1999
53. Lowe NJ, Breeding J, Wortzman MS: The pharmacological variability of crude coal tar. Br J Dermatol 126:608, 1992
54. Pittelkow MR, Perry HO, Muller SA, et al: Skin cancer in patients with psoriasis treated with coal tar: a 25-year follow-up study. Arch Dermatol 117:465, 1981
55. Fiore M: Practical aspects of anthralin therapy. Cutis 46:351, 1990
56. Abel EA, O’Connell BM, Farber EM: Psoriasis Day Care Center treatment at Stanford: part-time and full-time programs. Int J Dermatol 26:500, 1987
57. Schaefer H, Farber EM, Goldberg L, et al: Limited application period for dithranol in psoriasis: preliminary report on penetration and clinical efficacy. Br J Dermatol 102:571, 1980
58. Volden G, Bjornberg A, Tegner E, et al: Short-contact treatment at home with micanol Acta Derm Venereol Suppl (Stockh) 172:20, 1992
59. Even-Paz Z, Gumon R, Kipnis V, et al: Dead Sea sun vs. Dead Sea water in the treatment of psoriasis. Dermatol Treat 7:83, 1996
60. Frentz G, Olsen JH, Avrach WW: Malignant tumours and psoriasis: climatotherapy at the Dead Sea. Br J Dermatol 141:1088, 1999
61. Petrozzi JW, Barton JO, Kaidbey KH, et al: Updating the Goeckerman regimen for psoriasis. Br J Dermatol 98:437, 1978
62. Lowe NJ, Wortzman MS, Breeding J, et al: Coal tar phototherapy for psoriasis reevaluated: erythemogenic versus suberythemogenic ultraviolet with a tar extract in oil and crude coal tar. J Am Acad Dermatol 8:781, 1983
63. Stern RS, Gange RW, Parrish JA, et al: Contribution of topical tar oil to ultra-violet B phototherapy for psoriasis. J Am Acad Dermatol 14:742, 1986
64. Lowe NJ, Stern RS: Contribution of topical tar oil to ultraviolet B phototherapy for psoriasis. J Am Acad Dermatol 15:1053, 1986
65. Barbagallo J, Spann CT, Tutrone WD, et al: Narrowband UVB phototherapy for the treatment of psoriasis: a review and update. Cutis 68:345, 2001
66. Dawe RS, Cameron H, Yule S, et al: UV-B phototherapy clears psoriasis through local effects. Arch Dermatol 138:1071, 2002
67. Abel EA: Administration of PUVA therapy: protocols, indications, and cautions. Photochemotherapy in Dermatology. Abel EA, Ed. Igaku-Shoin Medical Publishers, New York, 1992, p 75
68. Stern RS, Laird N: The carcinogenic risk of treatments for severe psoriasis. Cancer 73:2759, 1994
69. Stern RS, Thibodeau LA, Kleinerman RA, et al: Risk of cutaneous carcinoma in patients treated with oral methoxsalen photochemotherapy for psoriasis. N Engl J Med 300:809, 1979
70. Stern RS, Laird N, Melski J, et al: Cutaneous squamous-cell carcinoma in patients treated with PUVA. N Engl J Med 310:1156, 1984
71. Stern RS, Nichols KT, Vakeva LH: Malignant melanoma in patients treated for psoriasis with methoxsalen (psoralen) and ultraviolet A radiation (PUVA). The PUVA Fol-low-Up Study.N Engl J Med 336:1041, 1997
73. Lerman S, Borkman RF: A method for detecting 8-methoxypsoralen in the ocular lens. Science 197:1287, 1997
74. Lerman S: Ocular phototoxicity and psoralen plus ultraviolet radiation (320–400 nm) therapy: an experimental and clinical evaluation. J Natl Cancer Inst 69:287, 1982
75. Malanos D, Stern RS: Psoralen plus ultraviolet A does not increase the risk of cataracts: a 25-year prospective study. J Am Acad Dermatol 57:231, 2007
76. Jeffes EB III, McCullough JL, Pittelkow MR, et al: Methotrexate therapy of psoriasis: differential sensitivity of proliferating lymphoid and epithelial cells to the cytotoxic and growth-inhibitory effects of methotrexate. J Invest Dermatol 104:183, 1995
77. Roenigk HH Jr, Auerbach R, Maibach H, et al: Methotrexate in psoriasis: consensus conference. J Am Acad Dermatol 38:478, 1996
78. Langman G, Hall PM, Todd G: Role of non-alcoholic steatohepatitis in methotrexate-induced liver injury. J Gastroenterol Hepatol 16:1395, 2001
79. Gilbert SC, Lintmalm G, Menter A, et al: Methotrexate-induced cirrhosis requiring liver transplantation in three patients with psoriasis: a word of caution in light of the expanding use of this “steroid-sparing” agent. Arch Intern Med 150:889, 1990
80. Chalmers RJ, Kirby B, Smith A, et al: Replacement of routine liver biopsy by procollagen III aminopeptide for monitoring patients with psoriasis receiving long-term methotrexate: a multicentre audit and health economic analysis. Br J Dermatol 152:444, 2005
81. Strober BE, Menon K: Folate supplementation during methotrexate therapy for patients with psoriasis. J Am Acad Dermatol 53:652, 2005
82. Al-Awadhi A, Dale P, McKendry RJ: Pancytopenia associated with low dose methotrexate therapy: a regional survey. J Rheumatol 20:1121, 1993
83. Lebwohl M: Acitretin in combination with UVB or PUVA. J Am Acad Dermatol 4:S22, 1999
84. Lebwohl M, Drake L, Menter A, et al: Consensus conference: acitretin in combination with UVB or PUVA in the treatment of psoriasis. J Am Acad Dermatol 45:544, 2001
85. Roenigk HH Jr, Callen JP, Guzzo CA, et al: Effects of acitretin on the liver. J Am Acad Dermatol 41:585, 1999
86. Larsen FG, Jakobsen P, Knudsen J, et al: Conversion of acitretin to etretinate in psoriatic patients is influenced by ethanol J Invest Dermatol 100:623, 1993
87. DiGiovanna JJ, Sollitto RB, Abangan DL, et al: Osteoporosis is a toxic effect of longterm etretinate therapy. Arch Dermatol 131:1263, 1995
88. Wilson DJ, Kay V, Charig M, et al: Skeletal hyperostosis and extraosseous calcification in patients receiving long-term etretinate (Tigason). Br J Dermatol 119:597, 1988
89. Stern RS, Fitzgerald E, Ellis CN, et al: The safety of etretinate as long-term therapy for psoriasis: results of the Etretinate Follow-Up Study. J Am Acad Dermatol 33:44, 1995
90. Lebwohl M, Ellis C, Gottlieb A, et al: Cyclosporine consensus conference: with emphasis on the treatment of psoriasis. J Am Acad Dermatol 39:464, 1998
91. Raman GV, Campbell SK, Farrer A, et al: Modifying effects of amlodipine on cyclosporin A–induced changes in renal function in patients with psoriasis. J Hypertens Suppl 16:S39, 1998
92. Zachariae H, Kragballe K, Hansen HE, et al: Renal biopsy findings in long-term cyclosporin treatment of psoriasis. Br J Dermatol 136:531, 1997
93. Lowe NJ, Wieder JM, Rosenbach A, et al: Long-term low-dose cyclosporine therapy for severe psoriasis: effects on renal function and structure. J Am Acad Dermatol 35:710, 1996
94. Jensen P, Hansen S, Moller B, et al: Skin cancer in kidney and heart transplant recipients and different long-term immunosuppressive therapy regimens. J Am Acad Dermatol 40:177, 1999
95. Srivastava T, Zwick DL, Rothberg PG, et al: Posttransplant lymphoproliferative disorder in pediatric renal transplantation. Pediatr Nephrol 13:748, 1999
96. van den Borne BE, Landewe RB, Houkes I, et al: No increased risk of malignancies and mortality in cyclosporin A–treated patients with rheumatoid arthritis. Arthritis Rheum 41:1930, 1998
97. Systemic tacrolimus (FK 506) is effective for the treatment of psoriasis in a double-blind, placebo-controlled study. The European FK 506 Multicenter Psoriasis Study Group. Arch Dermatol 132:419, 1996
98. Smith CH: Use of hydroxyurea in psoriasis. Clin Exp Dermatol 24:2, 1999
99. Gupta AK, Ellis CN, Siegel MT, et al: Sulfasalazine improves psoriasis: a double-blind analysis. Arch Dermatol 126:487, 1990
100. Roenigk HH Jr: Acitretin combination therapy. J Am Acad Dermatol 41:S18, 1999
101. Wong KC, Georgouras K: Low dose cyclosporin A and methotrexate in the treatment of psoriasis. Acta Derm Venereol 79:87, 1999
102. Asawanonda P, Nateetongrungsak Y: Methotrexate plus narrowband UVB phototherapy versus narrowband UVB phototherapy alone in the treatment of plaque-type psoriasis: a randomized, placebo-controlled study. J Am Acad Dermatol 54:1013, 2006
103. Morison WL, Momtaz K, Parrish JA, et al: Combined methotrexate–PUVA therapy in the treatment of psoriasis. J Am Acad Dermatol 6:46, 1982
104. Stern RS, Laird N: The carcinogenic risk of treatments for severe psoriasis. Photochemotherapy Follow-up Study. Cancer 73:2759, 1994
105. Kirby B, Yates VM: Mycophenolate mofetil for psoriasis. Br J Dermatol 139:357, 1998
106. Epinette WW, Parker CM, Jones EL, et al: Mycophenolic acid for psoriasis: a review of pharmacology, long-term efficacy, and safety. J Am Acad Dermatol 17:962, 1987
107. Zackheim HS, Glogau RG, Fisher DA, et al: 6-Thioguanine treatment of psoriasis: experience in 81 patients. J Am Acad Dermatol 30:452, 1994
108. Silvis NG, Levine N: Pulse dosing of thioguanine in recalcitrant psoriasis. Arch Dermatol 135:433, 1999
109. Krueger GG: Selective targeting of T cell subsets: focus on alefacept: a remittive therapy for psoriasis. Expert Opin Biol Ther 2:431, 2002
110. Hodak E, David M: Alefacept: a review of the literature and practical guidelines for management. Dermatol Ther 17:383, 2004
111. Gordon KB, Langley RG: Remittive effects of intramuscular alefacept in psoriasis. J Drugs Dermatol 2:624, 2003
112. Lebwohl M, Tyring SK, Hamilton TK, et al: A novel targeted T-cell modulator, efalizumab, for plaque psoriasis. Efalizumab Study Group. N Engl J Med 349:2004, 2003
113. Leonardi CL: Efalizumab in the treatment of psoriasis. Dermatol Ther 17:393, 2004
114. Gordon KB, Papp KA, Hamilton TK, et al: Efalizumab for patients with moderate to severe plaque psoriasis: a randomized controlled trial. Efalizumab Study Group. JAMA 290:3073, 2003
115. Leonardi CL, Powers JL, Matheson RT, et al: Etanercept as monotherapy in pa tients with psoriasis. Etanercept Psoriasis Study Group. N Engl J Med 349:2014, 2003
116. Brown SL, Greene MH, Gershon SK, et al: Tumor necrosis factor antagonist therapy and lymphoma development: twenty-six cases reported to the Food and Drug Administration. Arthritis Rheum 46:3151, 2002
117. Chaudhari U, Romano P, Mulcahy LD, et al: Efficacy and safety of infliximab monotherapy for plaque-type psoriasis: a randomized trial. Lancet 357:1842, 2001
118. Chung ES, Packer M, Lo KH, et al: Randomized, double-blind, placebo-controlled, pilot trial of infliximab, a chimeric monoclonal antibody to tumor necrosis factor-alpha, in patients with moderate-to-severe heart failure: results of the anti-TNF Therapy Against Congestive Heart Failure (ATTACH) trial. Anti-TNF Therapy Against Congestive Heart Failure Investigators. Circulation 107:3133, 2003
119. Keane J, Gershon S, Wise RP, et al: Tuberculosis associated with infliximab, a tumor necrosis factor alpha-neutralizing agent. N Engl J Med 345:1098, 2001
120. Menter A, Tyring SK, Gordon K, et al: Adalimumab therapy for moderate to severe psoriasis: a randomized, controlled phase III trial. J Am Acad Dermatol Oct 11, 2007 [Epub ahead of print]