Biomarcadores Cardiovasculares
Biomarcadores Cardiovasculares
|
Artigo original: Gandhi, U.P, MD. Januzzi Jr, LJ., MD. Cardiovascular Biomarkers. SAM. [The original English language work has been published by DECKER INTELLECTUAL PROPERTIES INC. Hamilton, Ontario, Canada. Copyright © 2015 Decker Intellectual Properties Inc. All Rights Reserved.] Tradução: Paulo Henrique Machado. Revisão técnica: Dr. Lucas Santos Zambon. |
Parul U. Gandhi, MD
Membro da Equipe Clínica e de Pesquisa no Departamento de Medicina da Divisão de Cardiologia do Massachusetts General Hospital (Boston, MA)
James L. Januzzi Jr., MD
Pesquisador Clínico do Roman W. DeSanctis do Departamento de Medicina da Divisão de Cardiologia do Massachusetts General Hospital. Professor de Medicina da Hutter Family Harvard Medical School (Boston, MA)
Resumo
O valor dos biomarcadores em circulação para cuidar de pacientes com doença cardiovascular aumentou de forma significativa nas últimas décadas. A maioria dos dados clínicos tem como focos o uso de peptídeos natriuréticos (PNs) para o diagnóstico, o prognóstico e o gerenciamento de pacientes com insuficiência cardíaca (IC) e as medições nos níveis de troponina cardíaca (Tn) em pacientes com suspeita ou confirmação de síndrome coronariana aguda (SCA). É provável que a razão para a adoção lenta de biomarcadores além dessas duas classes seja a limitação de modos ideais para a aplicação dos ensaios mais recentes. São necessários estudos complementares para esclarecer o uso de biomarcadores ? cuja meta final é simplificar o diagnóstico, o prognóstico e o tratamento de pacientes portadores de condições cardiovasculares complexas. Este artigo apresenta uma revisão do uso de biomarcadores cardiovasculares estabelecidos para IC, SCA e fibrilação atrial (FA). Os Quadros incluem um resumo dos biomarcadores emergentes e estabelecidos, as características do PN tipo B e do PN aminoterminal pró-tipo B (NT-proBNP), os pontos de corte para medição do nível de PNs, o diagnóstico diferencial de concentrações elevadas dos PNs, os biomarcadores em casos de IC com preservação da fração de ejeção, o resumo de testes de gerenciamento dos PNs, a terceira definição universal de infarto agudo do miocárdio (IAM) e orientações para recomendações de biomarcadores nos casos de IC. As figuras descrevem as várias causas de liberação de PNs, o mecanismo complexo da liberação de Tn em pacientes com IC, as etiologias isquêmicas e não isquêmicas da liberação de Tn, o tempo para a liberação de biomarcadores durante os IAMs e os biomarcadores envolvidos na patogênese de FA. Os algoritmos mostram a avaliação de pacientes ambulatoriais com dispneia, no uso clínico de PNs em exames completos, e o uso de Tn para facilitar a escolha de uma estratégia apropriada de gerenciamento de pacientes com SCA.
|
biomarcadores cardiovasculares |
O valor dos biomarcadores em circulação para cuidar de pacientes com doença cardiovascular aumentou de forma significativa nas últimas décadas. Com os aprimoramentos no desenvolvimento de ensaios para marcadores potencialmente úteis, ocorreram também grandes esforços para aperfeiçoar a melhor aplicação desses testes.
A despeito do enorme sucesso na compreensão da biologia dessas substâncias em circulação em pacientes portadores de doenças cardíacas, a maior parte dos dados clínicos tem como focos o uso de peptídeos natriuréticos (PNs) para o diagnóstico, o prognóstico e o gerenciamento de pacientes com insuficiência cardíaca (IC) e as medições dos níveis de troponina cardíaca (Tn) em pacientes com suspeita de síndrome coronariana aguda (SCA). Em parte, a razão para adoção lenta de biomarcadores além dessas duas classes tem sido uma limitação nos modos aplicativos ideais de novos ensaios.
Morrow e Lemos estabeleceram três critérios para biomarcadores úteis:
possibilitar medições rápidas e precisas com tempos curtos de respostas a um custo razoável;
fornecer informações adicionais, isto é, além do que poderia ser constatado a partir de avaliações clínicas completas;
utilizar resultados para facilitar a tomada de decisões clínicas.
O último critério é o mais difícil de todos, embora esforços recentes tenham como foco descobrir a melhor forma de aplicação de marcadores além das Tns, dos PNs e de outros marcadores selecionados. Foi feita, aqui, a revisão do uso de biomarcadores estabelecidos para alguns dos diagnósticos mais comuns em cardiologia: IC, SCA e fibrilação atrial (FA).
O Quadro 1 apresenta um resumo dos biomarcadores emergentes e estabelecidos para um amplo conjunto de doenças cardiovasculares.
Quadro 1
|
biomarcadores cardiovasculares | ||
|
Esforço/alongamento miocítico |
Família de PNs
|
NT-proBNP BNP ANP MR-proANP |
|
ST2 solúvel |
| |
|
Fator diferenciador do crescimento-15 |
| |
|
Provasopressina C-terminal (copeptina) |
| |
|
Neuro-hormônios |
Endotelina-1 |
|
|
Vasopressina |
| |
|
Aldosterona |
| |
|
Angiotensina II |
| |
|
Proadrenomedulina midregional |
| |
|
Síndrome cardiorrenal |
Lipocalina associada à gelatinase de neutrófilos (NGAL) |
|
|
N-acetil-ß-glucosaminidase |
| |
|
Mólecula-1 de lesão renal |
| |
|
Cistalina C |
| |
|
Trombose |
FvW |
|
|
D-Dímero
|
| |
|
Ligante solúvel do CD40 |
| |
|
Fibrose |
ST2 solúvel |
|
|
Galectina-3 |
| |
|
Colágeno tipo I do propeptídeo C-terminal |
| |
|
Colágeno tipo I do telopeptídeo C-terminal |
| |
|
Pró-colágeno tipo III do peptídeo C-terminal |
| |
|
Metaloproteinases de matriz |
| |
|
Lesão/Necrose |
TnI, TnT e equivalentes de alta sensibilidade |
|
|
CKMB |
| |
|
Proteína tipo cardíaca de ligação com ácidos graxos |
| |
|
Inflamação |
CRP; CRP de alta sensibilidade |
|
|
Interleucina-6 |
| |
|
Fator de necrose tumoral-a |
| |
|
Mieloperoxidase |
| |
|
Proteína A plasmática associada à gravidez |
| |
|
Genômica |
MicroRNAs |
|
ANP: peptídeo natriurético atrial; BNP: peptídeo natriurético tipo B; CKMB: creatina quinase-MB; CRP: proteína C-reativa; FvW: fator de von Willebrand; MR-proANP: pró-peptídeo ANP médio regional; NT-proBNP: peptídeo natriurético aminoterminal pró-tipo B; TnI: troponina I; TnT: troponina T.
Insuficiência cardíaca
A IC afeta 5 milhões de pessoas somente nos EUA, e são diagnosticados 800 mil casos a cada ano.2 Os biomarcadores foram estudados em pacientes com IC para fins de diagnóstico, prognóstico e gerenciamento. Esta seção apresentará discussões sobre PNs, Tn, galectina-3 e ST2 solúvel (sST2).
Peptídeos natriuréticos
Os PNs (peptídeo natriurético tipo B [BNP] e peptídeo natriurético aminoterminal pró-tipo B [NT-proBNP]) são os biomarcadores de padrão ouro mais recentes para a avaliação e o gerenciamento de pacientes com IC.
Biologia
A classe hormonal de PNs consiste de um grande grupo de peptídeos, sendo que a maioria deles tem efeitos biológicos sobre o tônus vascular, a exemplo do que ocorre com o sal e a eliminação hídrica. Descobriu-se que esses peptídeos são altamente conservados em todas as espécies e mostram evidências de que exercem um papel importante desde os peixes teleósteos3 até os grandes mamíferos.
O primeiro membro dessa família foi descoberto em 1981, época em que Bold e colaboradores isolaram o peptídeo natriurético atrial (em inglês, atrial natriuretic peptide [ANP]) nos tecidos atriais de ratos.4 O BNP, inicialmente conhecido por PN “cerebral”, foi descoberto em 1988 a partir de tecidos neutros suínos.5 Trabalhos subsequentes esclareceram a presença de um papel cardiovascular importante do BNP no coração.
A Figura 1 mostra as diversas causas de liberação do PN.
EA: estenose aórtica; EM: estenose mitral; EP: embolia pulmonar; IC: insuficiência cardíaca; IR: insuficiência renal; PN: peptídeo natriurético; RA: regurgitação aórtica; RM: regurgitação mitral; VE: ventrículo esquerdo.
*Estado de débito elevado.
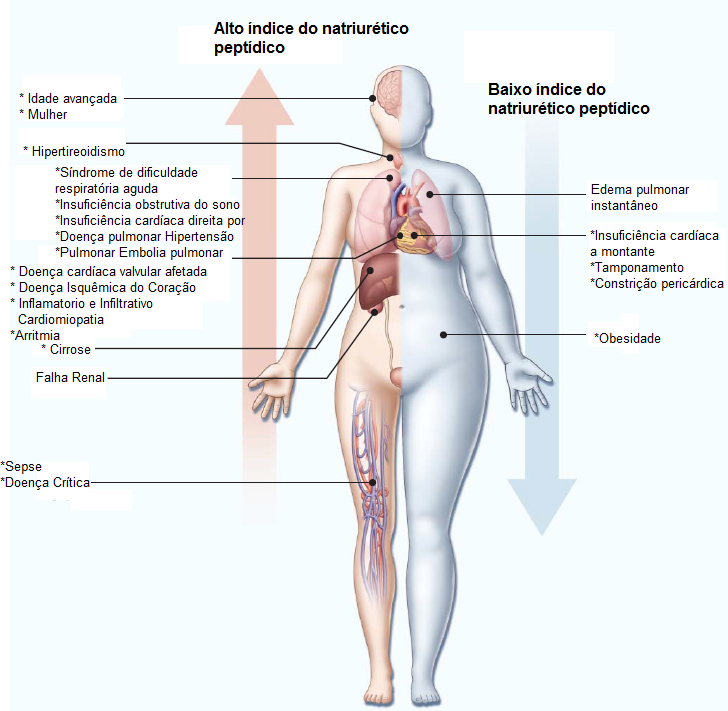
Figura 1 - Causas de liberação do PN.
DÍSTICOS DA FIGURA 1
|
Higher natriuretic peptide (NP) concentrations |
= |
Concentrações mais elevadas do PN
|
|
Lower natriuretic peptide (NP) concentrations |
= |
Concentrações mais baixas do PN
|
|
Advanced age Female |
= |
Idade avançada Mulher
|
|
Hyperthyrodism |
= |
Hipertireoidismo
|
|
Acute respiratory distress syndrome Obstructive sleep apnea Right heart failure from lung disease Pulmonary hypertension Pulmonary embolism |
= |
Síndrome do desconforto respiratório agudo Apneia obstrutiva do sono IC direita causada por doença pulmonar Hipertensão pulmonar EP
|
|
Flash pulmonar edema |
= |
Edema pulmonar rápido
|
|
Heart failure upstream from LV (MR, MS) Tamponade Pericardial constriction |
= |
IC no contrafluxo a partir do VE (RM, EM) Tamponamento Constrição pericárdica
|
|
Valvular disease affecting LV (AS, AR) Ischemic heart disease Inflamatory and infiltrative cardiomiopathy Arrhytmia |
= |
Doença valvular afetando o VE (EA, RA) Doença cardíaca isquêmica Cardiomiopatia inflamatória e infiltrativa Arritmia
|
|
Cirrhosis* |
= |
Cirrose*
|
|
Obesity |
= |
Obesidade
|
|
Renal failure |
= |
IR
|
|
Sepsis* Critical illness |
= |
Sepse* Enfermidade crítica |
O estímulo principal da ativação do gene do BNP é o estiramento miocárdico,6 embora diversos outros fatores possam desencadear a suprarregulação do gene do BNP. O BNP pode ser encontrado nos átrios e nos ventrículos; uma quantidade maior de BNP é produzida nos ventrículos por causa de sua massa maior.7
No momento da transcrição e da translação genética, ocorre a sintetização de um pró-peptídeo precursor do aminoácido 108 (proBNP108) no interior do cardiomiócito. No momento da liberação, há a clivagem do proBNP108 em um fragmento biologicamente ativo do aminoácido 32 (BNP) e em um fragmento N-terminal inerte do aminoácido 76 (NT-proBNP).7 O BNP e o NT-proBNP são mensuráveis no sangue periférico.
Dados mais recentes mostram que quantidades substanciais de proBNP108 biologicamente inerte e não clivado podem ser liberadas pelo coração, sobretudo no contexto de IC em estado avançado.8 Não é possível distinguir o proBNP108 do BNP livre com os ensaios usuais.9 Por conseguinte, acredita-se que seja um fenótipo prejudicial e inadequado em casos de IC em estado avançado.
Apesar disso, alguns especialistas defendem a realização de medições rotineiras do proBNP108. Além dos peptídeos tipo B, o ANP é também liberado pelo coração e possui desencadeadores semelhantes para sua síntese e liberação. Entretanto, ele é armazenado em grânulos densos e liberado mais rapidamente que o BNP (e o NT-proBNP) devido à necessidade de síntese desses últimos peptídeos.7
Desenvolveu-se um ensaio sobre o pró-peptídeo ANP médio regional (proANP médio regional [MR-proANP]) para uso clínico.10 Alguns estudos sugeriram que não há nenhuma diferença entre o valor diagnóstico e prognóstico do MR-proANP versus BNP/NT-proBNP.11,12 Ainda não se sabe se haverá o uso mais generalizado do MR-proANP.
O Quadro 2 mostra uma comparação entre o BNP e o NT-proBNP.
Quadro 2
|
DADOS COMPARATIVOS ENTRE BNP E NT-proBNP | ||
|
Características |
BNP |
NT-proBNP |
|
Aminoácidos |
32 |
76 |
|
Peso molecular (kDa) |
3,5 |
8,5 |
|
Meia-vida (minutos) |
˜20 |
˜120 |
|
Atividade hormonal |
Sim |
Não |
|
Eliminação |
Endopeptidases neutras; eliminação passiva por múltiplos órgãos.
|
Eliminação passiva por múltiplos órgãos. |
|
Correlação com a TFG |
++ |
+++
|
|
Faixa clínica (pg/mL) |
0?5.000 |
0?35.000 |
|
Variabilidade biológica |
40% |
25% |
BNP: peptídeo natriurético tipo B; NT-proBNP: peptídeo natriurético aminoterminal pró-tipo B; TFG: taxa de filtração glomerular.
Diagnóstico
Insuficiência cardíaca descompensada aguda. Nos dias atuais, o uso mais comum do BNP e do NT-proBNP é na avaliação de pacientes com insuficiência cardíaca descompensada aguda (em inglês, acutely decompensated heart failure [ADHF]). O teste de referência para o uso de PNs no diagnóstico de ADHF foi o Breathing Not Properly Multinational Study de 2002.13
Nesse estudo, a concentração de BNP de 100pg/mL apresentou uma sensibilidade de 90% e uma especificidade de 73% para IC, com uma razão de probabilidades (em inglês, odds ratio [OR]) de 29,60 para o diagnóstico de ADHF. Esse nível de desempenho foi muito mais preciso em comparação com quaisquer outras descobertas feitas em históricos ou em exames físicos.13
Da mesma forma que esse estudo, o teste ProBNP Investigation of Dyspnea in the Emergency Department (Pride) avaliou o uso do NT-proBNP em pacientes dispneicos que se apresentaram ao departamento de emergência. De uma forma análoga, o NT-proBNP teve uma sensibilidade de 90% e uma especificidade de 85%; além disso, o nível elevado de NT-proBNP foi um forte indicador de ADHF (OR de 44).14
Os pontos de corte para o BNP e o NT-proBNP para exclusão e diagnóstico de ADHF são distintos. Os médicos deveriam levar em conta que a concentração “normal” de BNP e NT-proBNP é consideravelmente mais baixa em pacientes com ADHF; por conseguinte, concentrações com valor preditivo negativo (VPN) elevado para excluir a presença de ADHF são bem mais baixas em comparação com aquelas com valor preditivo positivo (VPP) elevado para identificar o diagnóstico.
As variáveis clínicas devem sempre ser usadas em combinação com o conhecimento da fisiologia e com o diagnóstico diferencial de concentrações do PN para facilitar a interpretação dos valores conhecidos por “zona cinzenta” entre a “exclusão” e a “inclusão” de limiares.15
Cabe observar que, embora seja um único limiar de NT-proBNP de 900pg/mL, em comparação com o limiar documentado de um BNP de 100pg/mL no Breathing Not Properly Multinational Study, a estratificação por grupo etário de NT-proBNP melhorou o VPP do marcador (particularmente em idosos) e diminuiu a probabilidade de resultados na zona cinzenta.16
Além disso, ao interpretar as concentrações dos PNs, é imprescindível observar que, além do fator idade, as concentrações do BNP e NT-proBNP aumentam na presença de problemas na função renal ou com a maior complexidade de doenças cardíacas estruturais e tendem a ser baixas em pacientes obesos.17,18
Em geral, surgem áreas com algumas dificuldades na avaliação de pacientes com insuficiência cardíaca crônica (ICC) e com sintomas que poderão indicar a ocorrência de alguma alteração no estado clínico. Nesses indivíduos, as medições nas concentrações do BNP e do NT-proBNP podem ser bastante úteis para verificar a existência de alguma descompensação. Nesse contexto, as concentrações elevadas em 25% acima de um nível prévio estável na “linha de base” podem ser indicações de exacerbação da IC, em combinação com sinais e sintomas apropriados dessa condição.19,20
Insuficiência cardíaca crônica. Ainda que sejam mais amplamente utilizados na avaliação de ADHF, o BNP e o NT-proBNP são, de fato, úteis para a aplicação diagnóstica em situações menos críticas. Vários estudos clínicos mostraram que eles podem ser usados como adjuvantes nas avaliações clínicas de pacientes com dispneia e com possível IC subjacente.21,22
Nesse sentido, foi apresentada a sugestão de que o VPN do BNP e do NT-proBNP deveria ser determinado nas instituições de atendimento primário; valores abaixo do limiar do VPN excluem o diagnóstico de IC com um grau elevado de confiança. Por outro lado, valores acima desses limiares indicam que é necessário fazer um exame completo.
Insuficiência cardíaca com fração de ejeção preservada (HFpEF). A síndrome da HFpEF ? definida como a IC que afeta pacientes com fração de ejeção ventricular esquerda (Feve) igual ou superior a 50% ? afeta todos os indivíduos com IC, sendo que a incidência continua a se elevar.23,24
Prognóstico
Além do uso nos diagnósticos de IC, os PNs têm um papel fundamental nos prognósticos de pacientes com essa condição, sendo que as orientações mais recentes dos órgãos American College of Cardiology Foundation/American Heart Association (ACCF/AHA) atribuíram uma recomendação de nível de evidência A de Classe I para esse propósito.25
O Quadro 3 apresenta os pontos de corte para medições de PNs.
Quadro 3
|
PONTOS DE CORTE PARA MEDIÇÕES DE PEPTÍDEOS NATRIURÉTICOS | ||
|
Cenário clínico |
Valor de corte | |
|
Para excluir ADHF |
BNP |
<30?50pg/mL |
|
NT-proBNP |
<300pg/mL
| |
|
Para excluir ADHF ? Estratégia com um único ponto de corte |
BNP |
<100pg/mL |
|
NT-proBNP |
<900pg/mL
| |
|
Estratégia com diversos pontos de corte |
BNP, abordagem da “zona cinzenta” |
<100pg/mL, para excluir; 100?400pg/mL, “zona cinzenta”; >400pg/mL, para incluir. |
|
|
NT-proBNP, abordagem com “estratificação por idade” |
<450pg/mL para idade <50 anos; <900pg/mL para idades entre 50?75 anos; <1.800pg/mL para idades >75 anos. |
|
Pontos de corte no atendimento primário |
BNP, abordagem da “zona cinzenta” |
20pg/mL (assintomático); 40pg/mL (sintomático). |
|
|
NT-proBNP, abordagens com “estratificação por idade” |
<125pg/mL para idades <75 anos; <450pg/mL para idades =75 anos ou <50pg/mL para idades <51 anos; <75pg/mL para idades entre 50?75 anos; <250pg/mL para idades >75 anos. |
ADHF: insuficiência cardíaca descompensada aguda; BNP: peptídeo natriurético tipo B; IC: insuficiência cardíaca; NT-proBNP: peptídeo natriurético aminoterminal pró-tipo B.
Insuficiência cardíaca descompensada aguda. Conclui-se, no caso de pacientes com ADHF que se apresentam no departamento de emergência, que concentrações de NT-proBNP acima de 986pg/mL são os preditores independentes mais fortes de morte após 1 ano em análises multivariáveis com OR de 2,88, com possibilidade de se estender para 4 anos após a apresentação.26,27
Da mesma forma, as concentrações do BNP medidas no departamento de emergência foram fortes preditoras de admissão hospitalar para tratamento de IC e de morte.28 Além disso, os valores da zona cinzenta não deveriam ser considerados “negativos”, tendo em vista que estão associados a um aumento de risco em comparação com os resultados verdadeiramente negativos.15
Quadro 4
|
DIAGNÓSTICO DIFERENCIAL DE CONCENTRAÇÕES ELEVADAS DE PEPTÍDEO NATRIURÉTICO | |
|
Etiologias cardíacas |
IC (biventricular) SCA HVE Doença cardíaca valvular Doença pericárdica Arritmias atriais, cardioversão Miocardite Cirurgia cardíaca Anormalidades congênitas, incluindo derivações IR Anemia Idade avançada Apneia obstrutiva do sono EP Hipertensão pulmonar Queimaduras críticas Insultos metabólicos tóxicos (i.e., quimioterapia) Sepse |
EP: embolia pulmonar; HVE: hipertrofia ventricular esquerda; IC: insuficiência cardíaca; IR: insuficiência renal; SCN: síndrome coronariana aguda.
É importante observar que, após um episódio de descompensação, as pré-descargas de concentrações de PN são bem mais fortes para determinar o prognóstico. Um estudo retrospectivo de grande porte constatou que o resultado da descarga era superior para prever a mortalidade de 1 ano e a necessidade de nova hospitalização.29
Outro estudo recente que avaliou alterações na concentração de NT-proBNP durante períodos de hospitalização mostrou que um número menor de reduções de menos de 50% estava associado a um risco 57% mais elevado de readmissão hospitalar ou morte, em comparação com aquelas que haviam sofrido uma redução de mais de 50%, sendo que esse fato era independente da idade, do nível de creatinina, da presença de NT-proBNP na admissão e de fração de ejeção ventricular esquerda, entre outros fatores.30
Embora ainda não se saiba se a intervenção para concentrações especificamente mais baixas do BNP ou do NT-proBNP durante o curso da hospitalização para tratamento de ADHF está associada a melhores resultados, é razoável medir novamente as concentrações de cada um desses peptídeos após o tratamento para assegurar que houve alguma redução substancial.
A Figura 2 contém um algoritmo que mostra a avaliação de pacientes ambulatoriais com dispneia na clínica usando PNs no exame completo.
ECG: eletrocardiograma; IC: insuficiência cardíaca; PNs: peptídeos natriuréticos.
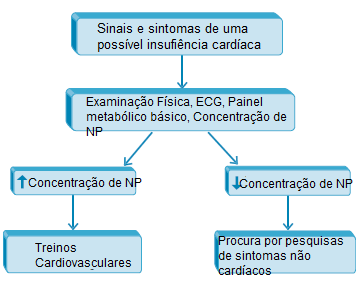
Figura 2 - Algoritmo que mostra a avaliação de pacientes ambulatoriais com dispneia na clínica usando PNs no exame completo.
DÍSTICOS DA FIGURA 2
|
Signs and symptoms of possible heart failure |
= |
Sinais e sintomas de uma possível IC
|
|
Physical examination, ECG, basic metabolic panel, NP concentration |
= |
Exame físico, ECG, painel metabólico básico, concentração do PN
|
|
? NP concentration |
= |
? concentração do PN
|
|
? NP concentration |
= |
?? concentração do PN
|
|
Cardiovascular workup |
= |
Exame cardiovascular completo
|
|
Search for noncardiac sources of symptoms |
= |
Procurar fontes não cardíacas dos sintomas
|
Insuficiência cardíaca crônica. As medições dos PNs ainda são prognósticas para pacientes com IC crônica; cada aumento de 100pg/mL no BNP corresponde a uma elevação de 25% no risco relativo de morte.31 Além disso, alterações nas concentrações de BNP e NT-proBNP ao longo do tempo ainda têm valor prognóstico e representam uma melhor abordagem para a estratificação de risco do que uma simples medição pontual.32,33 O BNP e o NT-proBNP também são prognósticos nos casos de HFpEF.
Gerenciamento
Insuficiência cardíaca descompensada aguda. Ainda que as alterações no BNP ou no NT-proBNP sejam substancialmente prognósticas durante o tratamento de ADHF, o papel da terapia orientada por PNs nessa situação ainda não foi totalmente esclarecido.25
O Quadro 5 apresenta os biomarcadores em IC com fração de ejeção preservada.
Quadro 5
|
BIOMARCADORES EM INSUFICIÊNCIA CARDÍACA COM FRAÇÃO DE EJEÇÃO PRESERVADA
| ||
|
Biomarcadores |
Diagnóstico |
Prognóstico
|
|
PNs |
Embora permaneçam diagnósticos, as concentrações são mais baixas em comparação com HFrEF;188 os pontos de corte são idênticos, porém ligeiramente menos sensíveis.189,190 |
Fator muito importante para prever mortalidade por todas as causas;191 para uma determinada concentração de BNP, o prognóstico é tão fraco quanto aquele para pacientes com HFrEF.188
|
|
Tn |
?* |
Níveis elevados de TnT estão associados a piores resultados em pacientes com ADHF.59
|
|
sST2 |
?* |
Concentrações mais baixas em comparação com HFrEF, embora mantenha a significância prognóstica.192
|
|
Galectina-3 |
?* |
Possivelmente tenha melhor valor prognóstico em comparação com HFrEF.193 |
ADHF: insuficiência cardíaca descompensada aguda; HFrEF: insuficiência cardíaca com fração de ejeção reduzida; PNs: peptídeos natriuréticos; sST2: ST2 solúvel; TnT: troponina T.
*Falta de dados para indicação. Cabe observar que não houve nenhum estudo específico que investigou o uso de biomarcadores no gerenciamento de pacientes com IC e fração de ejeção preservada.
Insuficiência cardíaca crônica. Tanto o BNP quanto o NT-proBNP têm um papel bem definido no diagnóstico e no prognóstico de IC, sendo que as medições seriais são mais importantes que as pontuais. É interessante observar que as terapias que oferecem benefícios para o prognóstico de IC têm, também, a tendência de apresentar concentrações mais baixas de BNP e de NT-proBNP.34
Esse fato levanta algumas dúvidas sobre a utilidade desses biomarcadores no tratamento de ICC; continuam em evolução os estudos que avaliam se o BNP ou o NT-proBNP podem orientar o gerenciamento dos casos de ICC.
O Quadro 6 apresenta o resumo dos testes de gerenciamento de PNs.
Quadro 6
|
RESUMO DOS TESTES DE GERENCIAMENTO DE PEPTÍDEOS NATRIURÉTICOS
| ||||||
|
Estudo |
Número de Pacientes |
HFpEF |
Alvo do PN |
Nível de PN mais baixo no braço do estudo |
Tratamento ativo diferente do braço de controle |
Resultado |
|
Starbrite194 |
130 |
Não |
BNP na alta hospitalar (=450pg/mL).
|
Não |
Sim |
Negativo |
|
Prima195 |
345 |
Sim |
NT-proBNP na alta hospitalar.
|
Não |
Não |
Negativo |
|
Signal-HF196 |
252 |
Não |
NT-proBNP 50% abaixo do valor de entrada do teste.
|
Não |
Não |
Negativo |
|
Upstep197 |
279 |
Não |
BNP <150pg/mL para idades <75 anos; BNP <300pg/mL para idades =75 anos.
|
Não relatado |
Não |
Negativo |
|
Time-CHF198 |
499 |
Não |
NT-proBNP <400pg/mL para idades <75 anos; NT-proBNP <800pg/mL para idades <75 anos.
|
Não |
Sim |
Neutro, mas com tendência positiva. |
|
Battle-Scarred199 |
364 |
Sim |
NT-proBNP <1.270pg/mL. |
Não |
Sim |
Neutro, mas com tendência positiva.
|
|
Troughton et al.35 |
69 |
Não |
NT-proBNP <1.692pg/mL.
|
Sim |
Não |
Positivo |
|
Stars-BNP200 |
220 |
Não |
BNP <100pg/mL. |
Sim |
Sim |
Positivo
|
|
Berger et al.201 |
278 |
Não |
NT-proBNP =2.200pg/mL.
|
Sim |
Sim |
Positivo
|
|
Protect202 |
151 |
Não |
NT-proBNP <1.000pg/mL.
|
Sim |
Sim |
Positivo
|
BNP: peptídeo natriurético tipo B; HFpEF: insuficiência cardíaca com fração de ejeção preservada; PN: peptídeo natriurético; NT-proBNP: peptídeo natriurético aminoterminal pró-tipo B.
Depois do estudo seminal realizado no ano de 2000 por Troughton e colaboradores, o qual apresentou melhores resultados nos casos em que se utilizou apenas o tratamento clínico padrão,35 diversos estudos passaram a considerar esse tipo de abordagem, produzindo resultados mistos.
Como esses estudos não conseguiram detectar nenhum benefício em relação à mortalidade, foi necessário fazer uma metanálise para demonstrar a real existência de algum benefício na sobrevida variando de 25 a 30% com o tratamento orientado por PNs, em especial nos casos de pacientes com idades abaixo de 75 anos.36-38 Essa pergunta será finalmente respondida pelo teste Guiding Evidence Based Therapy Using Biomarker Intensified Treatment (Guide-IT), que se encontra atualmente em andamento (http://clinicaltrials.gov/ct2/show/NCT01685840).
Apesar dos avisos de alerta descritos, surgiram vários conceitos fundamentais no contexto de estudos de tratamento de IC orientado por PNs. Os testes que, de forma comprovada, melhoraram os resultados usaram alvos mais baixos, com quedas significativas no nível de PNs, receberam mais visitas no braço orientado por biomarcadores e, com base nas orientações, aumentaram a titulação das medicações além dos diuréticos de alça.34
Além disso, a terapia para tratamento de IC orientada pelo NT-proBNP foi associada a uma melhor qualidade de vida em 50 pacientes que haviam sido tratados com essa abordagem39 e, aparentemente, esse tipo de tratamento está associado a melhoras nas dimensões e nas funções ventriculares no lado esquerdo, em comparação com a terapia padrão para IC.40
Dois estudos mostraram que o tratamento orientado pelo NT-proBNP pode ter uma boa relação custo-benefício.41,42 Nos casos de abordagens terapêuticas agressivas para tratamento de IC, é natural que surjam dúvidas sobre segurança, ainda que as análises dos maiores estudos feitas até o momento tenham demonstrado a segurança da terapia orientada por biomarcadores.43
Rastreamento/Prevenção
O valor de um biomarcador que possa identificar a presença de alguma doença cardíaca estrutural, assim como o risco do início de IC em pacientes aparentemente normais no tratamento primário é substancial. No que diz respeito a esse tema, os PNs foram investigados em indivíduos assintomáticos com o objetivo de identificar a presença de alguma doença cardíaca estrutural, como disfunção ventricular esquerda (DVE) assintomática ou anormalidades diastólicas, além de preverem o risco do início de IC.
Alguns estudos sugeriram que, embora as concentrações do BNP ou do NT-proBNP estejam associadas a fenótipos de risco mais elevado para o início de doenças cardíacas, elas são apenas substitutos fracos para a presença de DVE sistólica ou diastólica na ecocardiografia.44,45 A ligação entre BNP e NT-proBNP em relação a eventos cardiovasculares (incluindo início de IC) indica que esses biomarcadores podem revelar um fenótipo intermediário ou pré-clínico que não consiga ser detectado por meio dos estudos de imagens usuais.
A despeito da incapacidade para usar o BNP e o NT-proBNP como ferramentas de rastreamento para detectar doenças cardíacas específicas, esses marcadores conseguem prever o início de eventos de IC em indivíduos aparentemente normais. No Framingham Heart Study, os indivíduos com concentrações de BNP acima do 80º percentil tinham taxa de risco (em inglês, hazard ratio [HR]) ajustada de 3,07 para início de IC futura; as contrações do BNP também foram preditoras de mortalidade e de outros eventos cardíacos.46
De uma maneira análoga, em uma população relativamente idosa que participou do Cardiovascular Health Study, as concentrações do NT-proBNP na linha de base e no acompanhamento previam o início de IC, sobretudo no contexto de elevação das concentrações nas medições seriais.47
Ao informar possíveis intervenções em pacientes de atendimento primário com valores elevados dos PNs, dados recentes deram suporte ao valor potencial das estratégias que se baseiam nas concentrações do BNP ou do NT-proBNP para intensificar os cuidados de indivíduos nas clínicas de atendimento primário. Por exemplo, em um dos estudos, a redução de 40% no desenvolvimento de DVE ou IC clínica foi observada em pacientes com cuidados intensivos e com BNP acima de 50pg/mL.48
Em outro teste envolvendo pacientes com diabetes melito, a administração de cuidados mais agressivos estimulados pela identificação de níveis de NT-proBNP superiores a 125pg/mL resultou na redução de 65% na hospitalização ou na incidência de morte causada por eventos cardiovasculares no acompanhamento de 2 anos.49 Dados do Cardiovascular Health Study sugerem que a prática frequente de exercícios físicos diminui a probabilidade de elevação no NT-proBNP, com a consequente melhora no prognóstico.50
Troponina
A Tn foi usada principalmente no diagnóstico de SCA e ganhou importância no contexto de IC ? sobretudo no prognóstico de IC aguda (ICA) e ICC. A etiologia da elevação no nível de Tn em pacientes com IC é multifatorial, de modo que é extremamente importante conhecê-la. Com a evolução da nomenclatura de várias formas de infarto agudo do miocárdio (IAM), a Tn passou a ter um papel fundamental em relação à IC.51
Diagnóstico
Em primeiro lugar, embora a medição da Tn não seja aplicada como ferramenta diagnóstica para IC, sempre que se observar uma elevação na concentração de Tn em pacientes com IC (sobretudo no contexto de ICA), é importante verificar se essa elevação é secundária a um IAM tipo I causado por rompimento de placa ou ulceração.51
De maneira geral, a elevação no nível de Tn em casos de IC é produzida por IAM tipo II, observado em estados de desequilíbrio entre suprimento e demanda causado por elevações na pressão e estresse nas paredes, levando a uma isquemia subendocárdica.51 A Figura 3 apresenta outros mecanismos da liberação de Tn em pacientes com IC.52
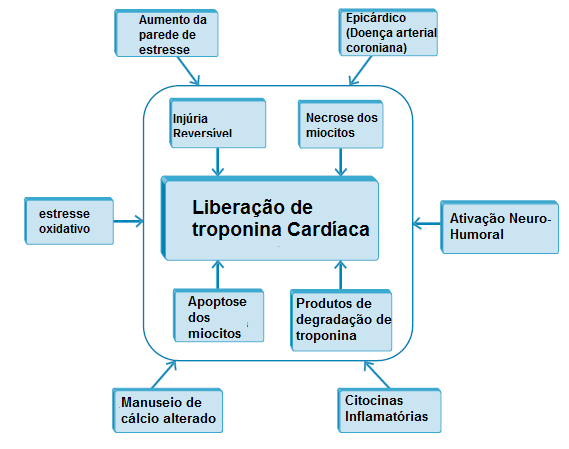
DAC: doença da artéria coronária; IC: insuficiência cardíaca; Tn: troponina.
Figura 3 - Mecanismo complexo da liberação de Tn em pacientes com IC.
Fonte: Kocil RD e colaboradores, com autorização da Elsevier.52
DÍSTICOS DA FIGURA 3
|
Increased wall stress |
= |
Aumento do estresse na parede
|
|
Epicardial CAD |
= |
DAC epicárdico
|
|
Reversible injury |
= |
Lesão reversível
|
|
Oxidative stress |
= |
Estresse oxidativo
|
|
Cardiac troponin release |
= |
Liberação de Tn cardíaca
|
|
Neurohormonal activation |
= |
Ativação neuro-hormonal
|
|
Myocite apoptose |
= |
Apoptose miocítica
|
|
Troponin degradation products |
= |
Produtos da degradação da Tn
|
|
Altered calcium handing |
= |
Alteração no tratamento do cálcio
|
|
Inflamatory citokines |
= |
Citocinas inflamatórias
|
Prognóstico
A maior parte dos dados sobre a liberação de Tn nos casos de IC informa seu papel no prognóstico e tem suporte orientador para essa indicação. As orientações dos ACCF/AHA para IC atribuem uma recomendação de Classe I para medições dos níveis de Tn nos casos de ADHF.25
Insuficiência cardíaca descompensada aguda. De acordo com o Acute Decompensated Heart Failure National Registry (Adhere), 62% dos pacientes hospitalizados com ADHF apresentaram Tn positiva com um ensaio convencional (TnI =1µg/L ou TnT =0,1µg/L), sendo que tinham taxa de mortalidade hospitalar significativamente mais elevada ? de 8,0% em comparação com 2,7% dos pacientes sem Tn positiva (p <0,001), com uma OR ajustada para morte de 2,55.33
Com o advento de ensaios de Tn ainda mais sensíveis (hsTn), um percentual bem mais elevado de indivíduos com IC passou a ter concentrações mensuráveis desse marcador; nesse contexto, foram observados valores prognósticos ainda mais elevados no teste.
O Quadro 7 apresenta a terceira definição universal de IAM.90
Quadro 7
|
TERCEIRA DEFINIÇÃO UNIVERSAL DE INFARTO AGUDO DO MIOCÁRDIO | |
|
Tipo 1: IAM espontâneo |
Relacionado a rompimento de placa, ulceração, fissura, erosão, dissecção com trombo intramural ou coronariano, resultando na redução do fluxo sanguíneo no miocárdio ou em embolização distal com necrose miocítica. |
|
Tipo 2: IAM secundário a um desequilíbrio isquêmico |
Lesão miocárdica resultante de um desequilíbrio entre o suprimento e a demanda de oxigênio miocárdico como disfunção endotelial coronariana, vasoespasmo, embolia coronariana, arritmia, anemia, insuficiência respiratória, hipotensão, hipertensão ± HVE. |
|
Tipo 3: IAM resultando em morte nos casos em que os resultados dos biomarcadores não estão disponíveis |
Morte cardíaca com sintomas que sugerem isquemia miocárdica e alterações presumidas em um novo ECG ou bloqueio do ramo esquerdo, tendo a morte ocorrido antes da coleta de amostras de sangue (ou no caso, raro, de ter havido coleta de amostras) ou antes da elevação nas concentrações do biomarcador. |
|
Tipo 4a: IAM relacionado à ICP |
Elevação na Tn >5xLSR do 99º percentil com valores normais na linha de base ou Tp >20% se os valores na linha de base forem elevados, forem estáveis ou estiverem em queda, mais um, no mínimo, dos seguintes sintomas: (a) sintomas de isquemia miocárdica; (b) novas alterações isquêmicas no ECG ou novo bloqueio no ramo esquerdo; (c) perda angiográfica de patência de uma grande artéria coronariana ou de um ramo, fluxo lento, sem fluxo, ou embolização; (d) imagens com nova perda de miocárdio viável ou novo movimento anormal da parede regional. |
|
Tipo 4b: IAM relacionado à trombose por stent |
Trombose causada por stent detectada por angiografia coronariana ou autópsia no contexto de isquemia miocárdica com elevação e/ou queda de biomarcadores, com, pelo menos, um valor >LSR do 99º percentil. |
|
Tipo 5: IAM relacionado à CRM |
Elevação dos biomarcadores cardíacos >10xLSR do 99º percentil em pacientes com Tn normal na linha de base com um, ou mais, dos seguintes fatores: (a) novas ondas Q patológicas ou bloqueio do ramo esquerdo no ECG; (b) oclusão por novo enxerto angiográfico ou nova oclusão de artéria nativa; (c) imagens com nova perda de miocárdio viável, nova anormalidade motora na parede regional. |
CRM: cirurgia de revascularização do miocárdio; ECG: eletrocardiograma; HVE: hipertrofia ventricular esquerda; ICP: intervenção coronariana percutânea; IAM: infarto agudo do miocárdio; LSR: limite superior de referência; Tn: troponina.
No exame, por exemplo, de pacientes com concentrações convencionais de Tn abaixo de 0,03ng/mL, o ensaio altamente sensível da TnT (hsTnT) melhorou a previsão de morte. Além disso, as concentrações de hsTnT acima de 20pg/mL foram associadas a um risco mais elevado de morte, com HR de 4,7 (IC 95%, 1,6?13,8; p = 0,005).54 Resultados semelhantes foram obtidos com a hsTnI.55
Insuficiência cardíaca crônica. Utilizando-se um ensaio convencional e um ensaio altamente sensível, a TnT foi estudada em, aproximadamente, 4 mil pacientes com ICC estável, de acordo com o Valsartan Heart Failure Trial (Val-HeFT), detectada em 10,4 e 92,0% da população, respectivamente. Nas medições com um ensaio convencional, a TnT foi associada à mortalidade (HR 2,08, IC 95%, 1,72?2,52) e nas situações em que a hsTnT foi adicionada nos modelos de previsão de risco, ocorreu uma melhora significativa no valor prognóstico.56
A hsTnT foi estudada posteriormente em 5.284 pacientes utilizando-se medições seriais nos testes Val-HeFT e no Gruppo Italiano per lo Studio dela Sopravvivenza nell’Insufficienza Cardiaca-HF (GISSI-HF), sendo que as elevações nas concentrações da hsTnT ao longo do tempo foram associadas a uma elevação na taxa de mortalidade por todas as causas com HR de 1,59 (1,39?1,82) e de 1,88 (1,50?2,35), respectivamente.57
Aparentemente, as concentrações elevadas de Tn permitem prever não apenas o risco de morte, mas também o declínio na função ventricular em pacientes com IC.58 Acredita-se que as concentrações de TnT e TnI (sobretudo nas medições com ensaios altamente sensíveis) forneçam informações prognósticas úteis nos casos de HFpEF.
Gerenciamento
Além do diagnóstico de IAM e da estratificação de risco, até o momento não foi realizado nenhum estudo que tenha usado medições de Tn para facilitar o gerenciamento específico de pacientes com IC.
Prevenção/Rastreamento
Entre os pacientes saudáveis de uma determinada comunidade, os indivíduos com níveis detectáveis de TnT apresentaram aumento no risco de morte cardiovascular e de mortalidade por todas as causas.60 Com embasamento no ensaio hsTnT, mesmo pequenas elevações (=0,003µg/L) foram associadas a um aumento no risco de mortalidade e de IC no estudo Atherosclerosis Risk in Communities (Aric);61 da mesma forma, concentrações detectáveis de hsTnT no Dallas Heart Study foram associadas a estruturas cardíacas anormais e a uma elevação no risco de mortalidade por todas as causas.62
Além disso, no Cardiovascular Health Study, as concentrações de hsTnT foram preditoras do início de IC e de morte nos anos subsequentes, embora as elevações nas concentrações de hsTnT tenham apresentado melhores prognósticos de IC, em comparação com a medição isolada na linha de base.63 Resultados prognósticos foram documentados com a hsTnT em estudos comunitários. Por exemplo, no Framingham Heart Study, as concentrações de hsTnT foram preditoras do início de IC e de eventos cardiovasculares, mesmo nas situações em que foram ajustadas para o BNP.64
Nos dias atuais, a exigência terapêutica de níveis elevados de hsTnT em pacientes comunitários sem doença cardíaca óbvia ainda não está suficientemente clara. Entretanto, no Cardiovascular Health Study, a elevação no hsTnT foi reduzida com quantidades maiores de exercícios aeróbicos,50 o que implicou no benefício de uma maior atenção à saúde cardiovascular.
St2 solúvel e galectina-3
O ST2 solúvel e a galectina-3 são dois biomarcadores recentes com ligações biológicas com a fibrose. O ST2 é um membro da família de receptores da interleucina-1 que é liberado em resposta ao esforço miocárdico,65 à remodelagem e à fibrose.66 A galectina-3 é expressa por macrófagos e está associada à fibrose cardíaca.67 Esses dois marcadores foram investigados extensivamente para prognóstico de IC, e ambos estão disponíveis para uso em diversos mercados, incluindo EUA e Europa. Nenhum deles têm alguma utilidade para o diagnóstico de IC.68,69
Prognóstico
Insuficiência cardíaca descompensada aguda. O ST2 solúvel está entre os mais fortes biomarcadores usados na previsão de eventos de IC e morte. Por exemplo, no estudo Pride, concentrações elevadas de sST2 foram associadas ao aumento no risco de mortalidade, mesmo quando foram ajustadas para uma ampla gama de variáveis clínicas e para outros biomarcadores com HR de 9,3 (IC 95%, 1,3?17,8; p = 0,03).70
Mais recentemente, o ST2 solúvel foi investigado em cerca de 5 mil pacientes com ADHF, e comprovou-se que é o mais forte biomarcador para previsão de morte, mesmo nas situações em que é adicionado aos fatores clínicos padrões usados na previsão de riscos.71 Além disso, nas medições seriais, os pacientes que apresentaram concentrações persistentemente elevadas do sST2 apresentaram as taxas de mortalidade mais elevadas (50%), em comparação com aqueles que tiveram concentrações baixas (3%).72
O valor prognóstico do ST2 solúvel esteve presente nos casos de ADHF mesmo quando foi ajustado para outros biomarcadores e claramente mais substancial nas medições seriais. Da mesma forma, a galectina-3 foi investigada em pacientes com ADHF. No estudo Pride, a galectina-3 apresentou uma OR de 10,3 (p <0,01) para a mortalidade de 60 dias em análises multivariáveis que incluíram o NT-proBNP.69
Ademais, a galectina-3 continuou prognóstica depois de 4 anos, sendo que os pacientes apresentaram dispneia com IC e concentrações elevadas desse biomarcador com uma taxa de mortalidade de 63%, em comparação com 37% naqueles com concentrações de galectina-3 abaixo da mediana.73 Aparentemente, a importância prognóstica da galectina-3 é mais modesta em comparação com o ST2 solúvel.
Insuficiência cardíaca crônica. O ST2 solúvel e a galectina-3 foram estudados para previsão de risco em pacientes com ICC. O ST2 solúvel foi investigado em 910 pacientes que participaram do teste Heart Failure: A Controlled Trial Investigating Outcomes of Exercise Training (HF-Action) e foi associado de forma significativa a resultados adversos, incluindo morte e hospitalização, tanto em análises univariáveis como em análises ajustadas, após o controle para variáveis clínicas e concentrações dos PNs.74
Outro estudo também avaliou o uso de ST2 solúvel em pacientes ambulatoriais crônicos com IC e chegou à conclusão que os pacientes no tercil mais alto de ST2 solúvel (>36,3ng/mL) tinham uma HR ajustada de 1,9 (IC 95%, 1,3?2,9; p = 0,002) para eventos adversos, em comparação com o tercil mais baixo; nesta análise, o sST2 foi adicionado ao NT-proBNP e ao Seattle Heart Failure Model, sendo que, aproximadamente, 15% de pacientes foram reclassificados em categorias de risco diferentes.75
No estudo ProBNP Outpatient Tailored Chronic Heart Failure Therapy (Protect), as concentrações seriais do ST2 solúvel foram preditoras mais fortes de risco que o NT-proBNP, o hsTNT, a galectina-3 ou a função renal.76 Além de preverem o risco de complicações cardiovasculares graves, as concentrações do ST2 solúvel conseguem antever a ocorrência de remodelagens ventriculares.
Em paralelo, a galectina-3 também foi estudada em indivíduos com ICC. Uma dessas investigações incluiu pacientes do Controlled Rosuvastatin Multinational Trial in Heart Failure (Corona) e dos testes Coordinating Study Evaluating Outcomes of Advising and Counseling in Heart Failure (Coach), e relatou que o aumento na concentração da galectina-3 de, pelo menos, 15% estava associado a uma taxa de mortalidade e de hospitalização bem mais elevada nos casos de pacientes que não haviam apresentado nenhuma alteração ou declínio na concentração da galectina-3.77
A utilidade das medições da galectina-3 ao longo do tempo foi investigada posteriormente em um subestudo do teste Protect, que demonstrou que as medições seriais adicionaram informações prognósticas complementares e que a galectina-3 deveria também ser utilizada na previsão de remodelagem ventricular esquerda por ecocardiografia.78
Da mesma forma como nos casos de ADHF, pelo que se pode observar, o mérito prognóstico da galectina-3 é mais modesto em comparação com o ST2 solúvel, e foi claramente inferior em uma comparação direta entre os dois marcadores.79 Levando-se em consideração o crescimento rápido do campo de biomarcadores, esse tipo de avaliação ganhará mais importância e ressaltará a necessidade de análises mais rigorosas e meticulosas.80
Gerenciamento
Não há estudos prospectivos que tenham avaliado as orientações de tratamento em pacientes com IC usando os biomarcadores ST2 solúvel e galectina-3. Entretanto, algumas análises retrospectivas sugerem que há uma interação entre o ST2 solúvel e os ß-bloqueadores76,81 e com a terapia com valsartana,82 de modo que as concentrações de sST2 permitiram prever benefícios específicos com sua utilização, e a aplicação desses medicamentos abaixaram reciprocamente os valores do ST2 solúvel.
Ademais, no estudo Corona, valores baixos de galectina-3 identificaram os pacientes com ICC, nos quais o tratamento com rosuvastatina não havia produzido nenhum benefício.83 A realização de outros estudos prospectivos para analisar o uso desses novos marcadores é imprescindível para orientar a terapia para tratamento de IC.
Rastreamento/Prevenção
O ST2 solúvel e a galectina-3 foram estudados em coortes de pacientes assintomáticos para avaliar riscos cardiovasculares futuros. Em cerca de 3 mil participantes do Framingham Heart Study, as medições do sST2 fizeram parte do painel de marcadores e, em análises ajustadas, foram associadas com morte (HR 1,32; IC 95%, 1,20?1,46; p <0,001), com IC (HR 1,45; IC 95%, 1,23?1,70; p <0,001) e com eventos cardiovasculares graves (HR 1,23; IC 95%, 1,10?1,39; p <0,001), mesmo quando foram ajustadas para variáveis clínicas e outros biomarcadores, incluindo o hsTnI.64
A galectina-3 também foi investigada no Framingham Heart Study e, em análises multivariáveis, descobriu-se que estava associada ao risco de IC incidente (HR 1,23; IC 95%, 1,04?1,47; p = 0,02) e à mortalidade por todas as causas (HR 1,15; IC 95%, 1,04?1,28; p = 0,01).84 Nos dias atuais, as implicações terapêuticas de concentrações elevadas desses marcadores não são muito claras no contexto de atendimento primário.
Recomendações das orientações
O Quadro 8 apresenta um sumário de recomendações das orientações da ACCF/AHA para o uso de biomarcadores em casos de IC.25
Quadro 8
|
RECOMENDAÇÕES DE BIOMARCADORES EM INSUFICIÊNCIA CARDÍACA | ||
|
Biomarcador |
Indicação |
Classe de Recomendação (Nível de Evidência)
|
|
PNs |
Diagnóstico/exclusão de IC (aguda e ambulatorial) |
I (A) |
|
Prognóstico de IC (aguda e ambulatorial) |
I (A) | |
|
Terapia orientada (ambulatorial) |
IIa (B) | |
|
Terapia orientada (aguda)
|
IIb (C) | |
|
Biomarcadores de lesão (Tn) |
Prognóstico (agudo e ambulatorial) |
I (A) |
|
Biomarcadores de fibrose (sST2 e galectina-3) |
Prognóstico (agudo) |
IIb A) |
|
Prognóstico (ambulatorial) |
IIb (B) | |
IC: insuficiência cardíaca; PNs: peptídeos natriuréticos; sST2: ST2 solúvel; Tn: troponina.
Aterosclerose e síndrome coronariana aguda
Em última análise, o processo de doença da aterosclerose leva ao desenvolvimento de DAC e da SCA. Embora a mortalidade causada pela DAC esteja declinando,85 esse tipo de doença continua a afetar a metade dos homens e um terço das mulheres na meia idade,86 sendo que em torno de 1,1 milhões de pacientes foram diagnosticados com SCA em 2010, entre os quais 74% tinham IC.87
Os biomarcadores cardíacos desempenham um papel fundamental no diagnóstico de IAM, e também têm sido usados para o prognóstico e o rastreamento de pacientes. Essa seção apresenta uma revisão do papel desempenhado pela Tn (incluindo a hsTn), da fração MB da creatina quinase (CK-MB), dos PNs e da proteína C-reativa (CRP) nesse contexto.
Troponina
As Tns são proteínas que ajudam a regular a contração dos músculos esqueléticos e cardíacos por meio da sinalização do cálcio. O complexo da Tn cardíaca consiste de TnI (possui essa denominação por causa da inibição da adenosina trifosfatase [ATPase] de actomiosina), TnC (ligação com cálcio) e TnT (ligação com a tropomiosina). A TnI e a TnT cardíacas são encontradas em duas áreas distintas no cardiomiócito: há um pequeno agrupamento citossólico de ambas (por exemplo, de 4 a 6%), enquanto que a maior parte de TnI e TnT é encontrada no aparelho contrátil cardíaco.
A TnI cardíaca é encontrada exclusivamente no músculo cardíaco,88 sendo que os ensaios para TnT têm como foco as isoformas cardíacas da proteína. Portanto, acredita-se que ambas sejam específicas para o tecido miocárdico, embora, em determinadas circunstâncias, os programas genéticos fetais poderão resultar na suprarregulação da TnT nos músculos esqueléticos; essa TnT “fetalizada” poderá entrar em reação cruzada com ensaios focados na TnT cardíaca.89
A TnI e a TnT são recomendadas para uso em pacientes com suspeita de IAM, considerando a sua sensibilidade para o diagnóstico e a quase completa especificidade cardíaca.90 A escolha do ensaio é determinada sobretudo por fatores laboratoriais.91 Conforme se pode observar, foram desenvolvidos ensaios específicos para a hsTn; para ser denominado “hsTn”, o marcador deve ser detectável em mais da metade de indivíduos saudáveis e, preferencialmente, acima de 95%.92 O advento desse tipo de ensaio causou um grande impacto sobre o diagnóstico e o prognóstico de IAM.
Diagnóstico
No contexto de isquemia miocárdica levando à necrose, as membranas das células são afetadas resultando na liberação rápida de conteúdos citoplasmáticos, incluindo a TnI e a TnT. Subsequentemente, ocorre uma separação mais tardia e a liberação do complexo de Tn com base em sarcômeros, resultando na liberação mais significativa e sustentada da proteína na circulação.91
Há algumas diferenças entre as concentrações medidas de TnI e TnT após a liberação, que se relacionam às diferenças nas concentrações citoplasmáticas, à estabilidade da proteína após a liberação, no estado de circulação dos dois marcadores e nas diferenças nas velocidades de eliminação.93
Infarto agudo do miocárdio. A definição de IAM determinada pela declaração de consenso da Universal Definition of Myocardial Infarction inclui “uma elevação e/ou queda nos valores dos biomarcadores cardíacos (preferencialmente a Tn cardíaca) com, pelo menos, um valor acima do limite superior de referência (URL) do 99º percentil”.90 Essa “elevação” foi posteriormente esclarecida pela National Academy of Clinical Biochemistry como uma elevação de 20% em relação à linha de base no acompanhamento serial.94
Sempre que se utilizar um ensaio convencional de Tn, recomenda-se coletar amostras seriais de sangue dentro de um período de tempo de 3 a 6 horas após a primeira avaliação, sendo que amostras repetidas devem ser medidas na presença de episódios isquêmicos recorrentes ou em caso de não se saber com precisão o tempo de início dos sintomas.95
Concentrações elevadas de Tn costumam ser observadas nos casos de lesões miocárdicas, e podem resultar de uma grande variedade de outras condições. Ademais, concentrações elevadas de Tn não indicam o mecanismo da lesão, o que enfatiza a significância do cenário clínico e do padrão dinâmico dos valores do biomarcador para que seja possível obter o diagnóstico correto.90
Em comparação com os ensaios tradicionais da Tn, os da hsTn mostram rotineiramente uma sensibilidade superior e uma discriminação para IAM, sobretudo em indivíduos que se apresentam dentro de um período de 2 horas após o início dos sintomas.97,98 Essa sensibilidade mais alta tem o custo de uma especificidade mais baixa;97,98 entretanto, em parte, a especificidade mais baixa resulta da reclassificação de angina instável para IAM com os métodos de hsTn.
Sempre que se utilizar os ensaios de hsTn, os médicos devem aplicar os conceitos baynesianos, que definem que a validade de um resultado pós-teste depende da probabilidade pré-teste para a presença do diagnóstico em pauta. Esse fato é especialmente importante, considerando que a probabilidade média de IAM antes de um teste em uma unidade de dor torácica nos EUA é relativamente baixa (<5%).99
Para atenuar essas preocupações, o uso de medições seriais em busca de uma elevação e/ou de uma queda é altamente recomendável, assim como o conhecimento de um diagnóstico diferencial mais amplo de níveis elevados de hsTn.
Uma das grandes vantagens do método de hsTn é que a sensibilidade mais elevada para necrose poderá ser utilizada para excluir o diagnóstico de IAM. Um estudo envolvendo 703 pacientes que utilizou o método de hsTn demonstrou que ocorreu IAM em 18,5% deles, sendo que nenhum tinha concentração não detectável da hsTn no momento da apresentação e apenas um com medição não detectável na apresentação desenvolveu um resultado elevado nos testes seriais, que produziu um VPN de 99,4% para excluir a hipótese de IAM.100
Reinfarto. Outro uso alternativo da Tn no diagnóstico de SCA é nas avaliações de reinfartos. Nas situações em que houver sinais e sintomas de recorrência de isquemia depois do evento indicador, deve-se medir imediatamente a Tn cardíaca e medir novamente mais tarde, dentro de um período de tempo de 3 a 6 horas.90
Prognóstico
Medições elevadas de Tn em pacientes com suspeita de SCA foram associadas a uma DAC mais complexa, a estenoses coronarianas mais graves sob o ponto de vista angiográfico, a uma carga maior de trombos e a graus reduzidos no fluxo de trombólise em IAM (em inglês, thrombolysis in myocardial infarction [Timi]), em comparação com pacientes com concentrações normais.101,102
Essa anatomia de risco mais elevado é preditora de piores resultados e, na realidade, uma metanálise que incluiu 21 estudos e quase 19 mil pacientes demonstrou que níveis elevados de Tn tinham uma OR para morte ou para reinfarto do miocárdio de 3,44 depois de 30 dias (IC 95%, 2,94?4,03; p <0,00001).103
A utilidade prognóstica dos ensaios com hsTn é incremental. Um estudo fez a comparação entre a hsTnT e a TnT convencional em 1.452 pacientes com SCA e concluiu que a hsTnT detectou um número maior de pacientes com risco elevado de eventos cardíacos subsequentes em comparação com o ensaio padrão.104
Outro estudo investigou a hsTnI em, aproximadamente, 4.700 pacientes com IAM sem supradesnivelamento do segmento ST (em inglês, non-ST-segment elevation myocardial infarction [NSTEMI]) e depois do ajuste para fatores de risco não convencionais de acordo com o sistema de pontuação Timi, sendo que os pacientes com concentrações da hsTnI acima do 99º percentil apresentaram um risco 3,7 vezes maior de morte cardiovascular ou de IAM depois de 30 dias, em comparação com aqueles com medições inferiores (9,7 versus 3,0%; p <0,001).105
A Figura 496 mostra as etiologias isquêmicas e não isquêmicas da liberação de Tn.
AVC: acidente vascular cerebral; EP: embolia pulmonar; IC: insuficiência cardíaca; IR: insuficiência renal; IAM: infarto agudo do miocárdio; Tn: troponina.
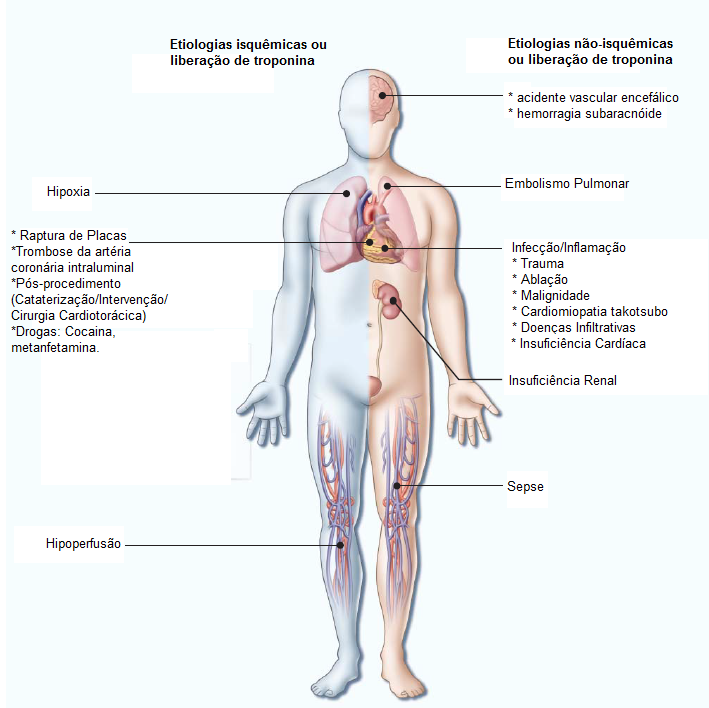
Figura 4 - Etiologias isquêmicas e não isquêmicas da liberação de Tn. As causas de isquemia de demanda (IAM tipo II) são apresentadas separadamente.
DÍSTICOS DA FIGURA 4
|
Ischemic etiologies of troponin release |
= |
Etiologias isquêmicas da liberação de Tn
|
|
Nonischemic etiologies of troponin release |
= |
Etiologias não isquêmicas da liberação de Tn
|
|
Stroke Subarachnoid hemorrhage
|
= |
AVC Hemorragia subaracnoide |
|
Hypoxia |
= |
Hipóxia
|
|
Pulmonary embolism |
= |
EP
|
|
Plaque rupture Intraluminal coronary artery thrombosis Demand ischemia* Postprocedure (catheterization/intervention, cardiothoracic surgery Drugs: cocaine, methamphetamine
|
= |
Rompimento de placa Trombose intraluminal da artéria coronária Isquemia de demanda* Pós-procedimento (cateterização/intervenção, cirurgia cardiotorácica Drogas: cocaína. Metanfetaminas. |
|
Etiologies of demand ischemia Tachy/brady arrhytmias Aortic dissection or severe aortic stenosis Severe anemia Hypertension/hypotension Coronary spasm Endothelial dysfunction Coronary embolism Respiratory failure |
= |
Etiologias da isquemia de demanda Taqui/bradiarritmias Dissecção aórtica ou estenose aórtica grave Anemia grave Hipertensão/hipotensão Espasmo coronariano Disfunção endotelial Embolia coronariana Insuficiência respiratória
|
|
Hypoperfusion |
= |
Hipoperfusão
|
|
Infection/inflamation (myocarditis, viral cardiomyopathy) Trauma Ablation Malignancy Takotsubo cardiomyopathy Infiltrative disease (amyloidosis, sarcoidosis) Heart failure |
= |
Infecção/inflamação (miocardite, cardiomiopatia viral)
Trauma Ablação Malignidade Cardiomiopatia de Takotsubo Doença infiltrativa (amiloidose, sarcoidose) IC
|
|
Renal failure |
|
IR |
|
Sepsis |
= |
Sepse
|
Gerenciamento
As medições de Tn são usadas rotineiramente para facilitar o gerenciamento de pacientes com SCA. Por exemplo, a Tn ajuda a estimar o tamanho dos infartos miocárdicos.106 Outro papel importante desempenhado pelas medições da Tn é a escolha da terapia para pacientes com SCA. Com frequência, os indivíduos com concentrações elevadas de TnI ou TnT têm mais doenças complexas com carga significativa de trombos.101,102
Portanto, alguns estudos comprovaram os benefícios obtidos com o uso dos inibidores da glicoproteína IIb/IIIa e heparina de baixo peso molecular em pacientes com concentrações elevadas de Tn;107,108 entretanto, os dados são mistos.109 Além das medicações, a aplicação precoce de estratégias invasivas (cateterização dentro de 24 horas após a admissão hospitalar) é particularmente benéfica para pacientes com concentrações elevadas de Tn.110,111
No entanto, é importante observar que o diagnóstico diferencial amplo de valores anormais de TnI ou TnT precisa ser levado em conta na aplicação desses biomarcadores para a tomada de decisões sobre o tratamento. A Figura 5 mostra um algoritmo para incorporar as medições de biomarcadores na estratégia de gerenciamento de pacientes com SCA.96
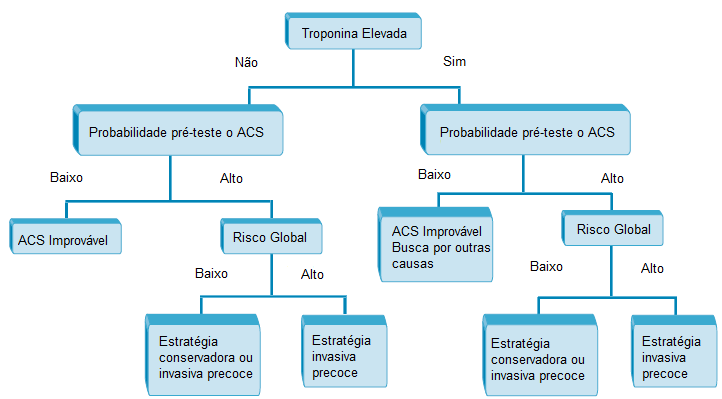
ECG: eletrocardiograma; SCA: síndrome coronariana aguda; Tn: troponina.
Figura 5 - Algoritmo demonstrando o uso de Tn para facilitar a determinação de uma estratégia de gerenciamento apropriada de pacientes com SCA.
Fonte: Newby LK e colaboradores, com permissão de Elsevier.96
DÍSTICOS DA FIGURA 5
|
Elevated troponin |
= |
Tn elevada
|
|
No |
= |
Não
|
|
Yes |
= |
Sim
|
|
Pretest probability of ACS (risk factors, symptons, ECG) |
= |
Probabilidade de SCA antes do teste (fatores de risco, sintomas, ECG)
|
|
Pretest probability of ACS (risk factors, symptons, ECG) |
= |
Probabilidade de SCA antes do teste (fatores de risco, sintomas, ECG)
|
|
Low |
= |
Baixa
|
|
High |
= |
Alta
|
|
Low |
= |
Baixa
|
|
High |
= |
Alta
|
|
ACS unlikely |
= |
SCA improvável
|
|
Global risk |
= |
Risco global
|
|
Low |
= |
Baixa
|
|
High |
= |
Alta
|
|
ACS unlikely Search for other causes |
= |
SCA improvável Procurar outras causas
|
|
Global risk |
= |
Risco global
|
|
Low |
= |
Baixa
|
|
High |
= |
Alta
|
|
Early conservative or invasive strategy |
= |
Estratégia inicial conservadora ou invasiva
|
|
Early invasive strategy |
= |
Estratégia inicial invasiva
|
|
Early conservative or invasive strategy |
= |
Estratégia inicial conservadora ou invasiva
|
|
Early invasive strategy |
= |
Estratégia inicial invasiva
|
Rastreamento/Prevenção
Em paralelo com outros biomarcadores cardiovasculares, foram avaliadas também as medições da Tn em pessoas saudáveis e assintomáticas.60,112 Um dos estudos concluiu que a TnT convencional é detectável (=0,01ng/mL) em apenas 30 entre, aproximadamente, mil pacientes idosos saudáveis em uma comunidade; porém, quando elevada, foi associada ao aumento no risco de mortalidade por todas as causas (HR 2,06; IC 95%, 1,29?3,28; p = 0,003) e de morte cardiovascular (HR 2,06; IC 95%, 1,03?4,12; p = 0,04).60
As Tns hsTnI ou hsTnT também foram investigadas em diversos estudos de grande porte.61,63,64 Da mesma forma como em pacientes que foram avaliados com IC ou com suspeita de SCA, os ensaios com a hsTn são claramente superiores aos métodos convencionais de previsão de resultados em pacientes aparentemente bens de saúde.61,63,64
Acredita-se, sob o ponto vista mecânico, que concentrações elevadas de hsTn (por exemplo, acima do 99º percentil) em indivíduos sem doença cardíaca conhecida reflitam a presença de aterosclerose subjacente na artéria coronária e/ou de doença nos músculos cardíacos62; valores mais elevados são observados também em indivíduos com doença renal crônica e diabetes melito, que são fatores de risco conhecidos para doença cardíaca.64ISOENZIMA MB DA CREATINA QUINASE
Antes do advento da Tn, a creatina quinase (em inglês, creatine kinase [CK]) e, subsequentemente, a isoforma cardíaca específica (MB) foram usadas nos diagnósticos de IAM. Atualmente, a CK é apenas uma nota de rodapé na avaliação de IAM e, por conseguinte, não deve ser utilizada se um método usando a Tn estiver disponível, tendo em vista que a sensibilidade e a especificidade são relativamente mais baixas, e também devido ao rápido surgimento dos métodos hsTn.
A Figura 6 mostra o tempo para liberação da Tn, da CKMB e da mioglobina (um biomarcador ainda menos específico de lesão miocárdica “precoce”).113
CKMB: creatina quinase-MB; IAM: infarto agudo do miocárdio; Tn: troponina.
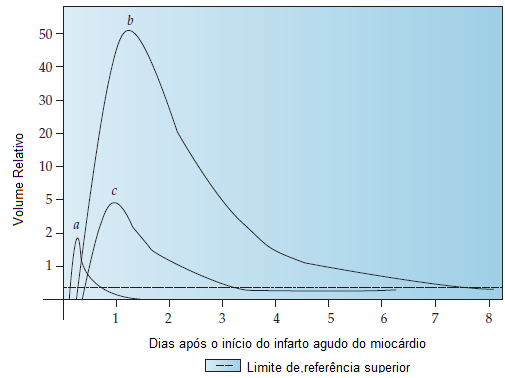
Figura 6 - Momento da liberação do biomarcador durante o IAM: (A) mioglobina, (B) Tn e (C) CKMB.
Fonte: Levandroswski e colaboradores, com permissão da American Society for Clinical Pathology.113 © 2002-2014 American Society for Clinical Pathology. © 2002-2014 American Journal of Clinical Pathology.
DÍSTICOS DA FIGURA 6
|
Relative value |
= |
Valor relativo
|
|
Days after onset of acute myocardial infarction |
= |
Dias após o início de IAM
|
|
Upper reference limit |
= |
Limite superior de referência
|
Peptídeos natriuréticos
Embora o papel principal da família de PNs seja nos casos de IC, alguns estudos analisaram esses peptídeos em pacientes com a SCA.
Diagnóstico
O fundamento lógico para usar PNs como ferramentas diagnósticas para SCA se baseia no fato de que a produção miocárdica e a liberação desses biomarcadores são disparadas parcialmente pela hipóxia/isquemia ao nível tecidual. Nesse aspecto, as concentrações de BNP em pacientes que se apresentam com suspeita de SCA foram consideradas bastante elevadas nos indivíduos com diagnóstico confirmado de IAM em um estudo (média de 92pg/mL versus 5,2pg/mL; p <0,01 na apresentação).114
É interessante observar que o curso de tempo da elevação do BNP em pacientes com padrões de infarto mais significativos ou com comprometimento ventricular esquerdo foi bifásico com um pico inicial depois de 16 horas após a apresentação e depois de 5 dias.114
Outro estudo investigou a utilidade do NT-proBNP em relação a outros marcadores, incluindo o TnT convencional e o hsTnT, em pacientes que se apresentaram com dor torácica; chegou-se à conclusão de que a adição de NT-proBNP a ambos os ensaios melhorou o índice líquido de reclassificação de SCA; ademais, a sensibilidade e o VPN de ambos os ensaios com Tn melhoraram nas situações em que o Tn e o NT-proBNP eram negativos.115
Prognóstico
Os PNs também foram avaliados para prognósticos em pacientes que se apresentam com SCA, e são bem estabelecidos como fortes medições prognósticas com adjuvantes da Tn para esse propósito.
Um estudo realizado com pacientes que se apresentaram com NSTEMI descobriu que os indivíduos com medições do NT-proBNP no quartil mais elevado na linha de base (=1.170ng/mL para homens; =2.150ng/mL para mulheres) apresentaram mortalidade de 1 ano, bem mais elevada em comparação com os pacientes nos três quartis mais baixos (7,3 versus 1,1%; p <0,0001), porém não foi detectada nenhuma associação significativa com IAM recorrente depois de 1 ano.116
Da mesma forma, concentrações do BNP acima de 80pg/mL na linha de base também foram associadas ao aumento no risco de morte e de IC em indivíduos com UA/NSTEMI.117 O tempo para as medições de BNP ou NT-proBNP para prognósticos em pacientes com SCA foi considerado ideal não apenas na admissão, mas também subsequentemente, de acordo com a avaliação de um subestudo do teste Fragmin and fast Revascularization during Instability in Coronary artery disease (FRISC-II), em que o NT-proBNP foi medido na linha de base depois de 48 horas, 6 semanas, 3 e 6 meses.118
Neste estudo, a concentração do NT-proBNP medida durante um período de tempo mais “estável” do acompanhamento foi uma melhor preditora de mortalidade que as concentrações mais próximas da linha de base;118 outros estudos sugeriram que esses valores convalescentes são preditores de remodelagem ventricular adversa, com risco de futura IC.119-121
De uma forma parecida com o BNP ou com o NT-proBNP, os biomarcadores de fibrose galectina-3 e, em especial, o ST2 solúvel são adjuvantes à Tn para prognósticos em pacientes com SCA. Nesse contexto, concentrações elevadas de galectina-3122 ou ST2 solúvel123,124 foram preditoras de IC incidente e/ou de morte em pacientes com Stemi ou NSTEMI, independentemente das concentrações do PN ou da Tn.
Gerenciamento
Entre os pacientes com UA/NSTEMI no subestudo Global Utilization of Strategies to Open Occluded Arteries (Gusto-IV), somente aqueles com NT-proBNP acima de 237pg/mL, ao que tudo indica, tiveram algum benefício com a revascularização precoce;125 esses resultados devem ser confirmados antes que o NT-proBNP seja amplamente utilizado para tomar decisões sobre a aplicação de gerenciamentos invasivos.
Proteína c-reativa
O foco no papel da inflamação na etiologia de doenças cardiovasculares levou à avaliação da CRP nesse tipo de contexto.126 Embora tenha sido estudada durante muitos anos, incluindo estudos seminais realizados por Elster e colaboradores na década de 1950 em pacientes com IC, a CRP foi estudada especificamente como biomarcadora para a avaliação e o gerenciamento de pacientes com aterosclerose.128
A CRP é um membro da família da pentraxina e consiste de cinco subunidades idênticas;129 sua produção é disparada pela interleucina-6 e pelo fator-a de necrose tumoral, e ocorre sobretudo em hepatócitos.130
O papel da CRP na aterosclerose envolve diversas rotas diferentes, incluindo estimulação da liberação do fator tecidual e redução na atividade do ativador do plasminogênio tecidual, resultando em um estado pró-trombótico, na ativação do sistema de complementos e na absorção do colesterol de lipoproteína de baixa densidade (LDL-C) por macrófagos que produzem células de espuma, uma etapa que faz parte integrante da patogênese da aterosclerose.131
Os ensaios para medição da CRP eram originalmente um pouco rudimentares e não padronizados. Com o avanço na tecnologia dos ensaios, foram desenvolvidos métodos de alta sensibilidade para testar a CRP; esses ensaios conseguem detectar concentrações de CRP abaixo de 0,3mg/mL e são mais amplamente utilizados na avaliação de riscos cardiovasculares.132
Os diagnósticos cardiovasculares em que a medição da CRP foi comprovadamente prognóstica são os de SCA,133 DAC,134 IC,135 doença cerebrosvacular136 e FA.137 Além dos casos de inflamação, as concentrações de CRP são mais altas em afro-americanos, em comparação com a população branca, e são mais elevadas em mulheres;138 a terapia de reposição hormonal também foi relacionada a concentrações elevadas.139
O tabagismo também é um estímulo potencial para elevações nas concentrações de CRP.140 É importante observar que há um forte vínculo entre obesidade visceral,141 assim como entre intolerância clínica à glicose e diabetes melito franca; esse fato levou os autores a especular se as concentrações de CRP podem ser usadas como uma forma alternativa para prever o risco fenotípico da síndrome metabólica.142
Para as medições da CRP, o Centers for Disease Control and Prevention/American Heart Association (CDC/AHA) recomenda a seguinte classificação de risco sempre que se utilizar algum ensaio de alta sensibilidade:132
baixo risco: menos de 1mg/L;
risco intermediário: 1 a 3mg/L;
risco elevado: acima de 3mg/L.
A CRP não produziu nenhum benefício para o diagnóstico de SCA e de DAC,143 embora tenha descoberto um nicho para estratificação de risco através do espectro da DAC.
Prognóstico
Síndrome coronariana aguda. A CRP foi estudada extensivamente em pacientes com SCA e, com frequência, descobriu-se que era uma preditora independente de mortalidade e de outros eventos cardiovasculares, mesmo em comparação com a Tn ou outros biomarcadores.133,144-146
Por exemplo, a medição da CRP na linha de base (usando-se um ensaio de alta sensibilidade, juntamente com a Tn no quadro de SCA), foi investigada em cerca de 7 mil pacientes que, posteriormente, foram subdivididos por quartis de concentrações do biomarcador. Os pacientes no quartil mais alto de CRP (>9,62mg/L) apresentaram uma mortalidade de 30 dias de 6,3%, em comparação com 2% no quartil mais baixo (=1,84mg/L); cabe observar que a CRP não foi considerada uma preditora significativa de IAM após 30 dias.
Nesse estudo, a Tn e a CRP apresentaram valor prognóstico independente.133 O valor da CRP para prognósticos em casos de SCA não se restringe apenas àqueles com IAM. Em pacientes com UA, fez-se a medição da CRP usando-se um ensaio de alta sensibilidade no momento da alta hospitalar, sendo que 67% dos indivíduos com concentrações de CRP iguais ou superiores a 8,7mg/L apresentaram recorrência de sintomas instáveis, em comparação com 13% daqueles com concentrações de CRP de 2,5mg/L ou menos.147
Doença arterial coronariana estável. Diversos estudos demonstraram o valor prognóstico independente da CRP em pacientes com DAC estável.134,148,149 Por exemplo, a CRP foi medida em 3.771 indivíduos com DAC estável com base em um ensaio de alta sensibilidade; concluiu-se que as concentrações de CRP entre 1 e 3mg/L estavam associadas a um aumento significativo no risco de morte cardiovascular, IAM ou acidente vascular cerebral (AVC) e com HR de 1,39 (IC 95%, 1,06?1,81; p = 0,016), ao passo que as concentrações superiores a 3mg/L apresentaram HR de 1,52 (IC 95%, 1,15?2,02; p = 0,003).134
Prevenção/Rastreamento
As medições da CRP foram amplamente utilizadas em estudos comunitários envolvendo pacientes ambulatoriais com estado de saúde aparentemente bom.150-153 Uma metanálise teve como foco a investigação da CRP como fator de risco para DAC. Nas situações em que foram levados em conta alguns estudos que ajustaram para os fatores de risco tradicionais de Framingham, o risco relativo de DAC incidente foi de 1,58 (IC 95%, 1,37?1,83) para concentrações de CRP acima de 3mg/L, em comparação com as concentrações abaixo de 1mg/L.150
Em testes clínicos que avaliaram a queda lipídica, inúmeros estudos revelaram que houve um valor aditivo e incremental nos testes de CRP em combinação com concentrações de LDL-C.154,155 Nesses estudos, houve uma baixa correlação entre concentrações de CRP e LDL-C, porém ambas as medições apresentaram valor independente para prever futuros eventos de DAC; nesses estudos, os pacientes com risco mais baixo tinham CRP (medida usando-se ensaios de alta sensibilidade) abaixo de 1mg/L e LDL-C inferior a 70mg/dL.155
Por outro lado, concentrações mais elevadas de CRP ou de LDL-C foram associadas aos níveis mais altos de risco.155 Cabe ressaltar que observações retrospectivas sugeriram que a terapia para abaixar o nível lipídico usando a terapia à base do inibidor da CoA redutase (“estatina”), 3-hidroxi-3-metil-glutaril, foi particularmente importante em pacientes com elevação na CRP ou no LDL-C, em especial nos casos em que os níveis de ambos eram elevados.156 Ao que tudo indica, em alguns estudos a terapia com estatinas abaixou também as concentrações de CRP ao longo do tempo.156,157
Para ganhar suporte prospectivo no uso das medições da CRP para orientar a aplicação da terapia com estatinas, o teste Justification for the Use of Statins in Primary Prevention: an Intervention Trial Evaluating Rosuvastatin (Jupiter) avaliou 17.802 pacientes saudáveis com níveis de LDL-C abaixo de 130mg/dL e concentrações de CRP (usando um ensaio de alta sensibilidade) iguais ou superiores a 2,0mg/L, que foram randomizados para receber 20mg de rosuvastatina ou placebo.158
O fundamento lógico desse estudo foi que esses pacientes não deveriam receber a terapia com estatinas com embasamento apenas nas respectivas LDL-C, tendo em vista que mesmo pequenas elevações na CRP seriam preditoras de risco nesse contexto. O teste foi interrompido logo após a descoberta da redução de 44% no risco no desfecho primário de IAM, AVC, revascularização arterial, hospitalização por UA ou morte cardiovascular. As concentrações de CRP e LDL-C foram reduzidas em 37 e 50%, respectivamente, no braço de rosuvastatina.158
Entretanto, esse teste levantou muitas controvérsias porque que não haviam sido incluídos pacientes com concentrações baixas de CRP, aumentando o nível de incerteza sobre a probabilidade de todos os pacientes se beneficiarem com a terapia com estatinas, ou se a CRP poderia selecionar aqueles indivíduos que realmente respondem à terapia.159
Todavia, a CRP atingiu uma recomendação de Classe IIa para medições em pacientes saudáveis para avaliar o benefício potencial da terapia com estatinas e uma recomendação de Classe IIb para rastreamento de DAC em indivíduos assintomáticos de risco intermediário com base nas orientações dos ACCF/AHA.160
Fibrilação atrial
A FA é o tipo mais comum de arritmia, com grande probabilidade de aumentar sua prevalência no futuro.161 Os processos miocárdicos que levam à FA são complexos e envolvem alterações fibróticas e inflamatórias.162,163 Além dos sintomas, os pacientes apresentam distúrbios de ritmo; uma preocupação importante com a FA é o risco tromboembólico que acompanha o diagnóstico.
Foram desenvolvidas pontuações de previsão de risco para complicações tromboembólicas como o sistema de pontuação Cardiac Failure, Hypertension, Age, Diabetes Stroke System (Chads) e o CHA2DS2-VASC (insuficiência ou disfunção cardíaca, hipertensão, idade =75 anos, diabetes melito, AVC/doença vascular, idade entre 65 e 74 anos e categoria sexual), embora seu valor preditivo seja moderado.164
Portanto, encontra-se atualmente em fase de estudo um papel potencial para os biomarcadores para facilitar o tratamento de pacientes com FA, incluindo a previsão de complicações tromboembólicas, FA incidental ou recorrência de FA após a recuperação do ritmo sinusal.
A Figura 7 mostra os diversos biomarcadores envolvidos na patogênese complexa da FA.
AVC: acidente vascular cerebral; BTG: timoglobulina ß; CRP: proteína C-reativa; FA: fibrilação atrial; FvW: fator de von Willebrand; HSP: proteína de choque térmico; IL: interleucina; miRNA: microRNA; MMP: matriz melatoproteinase; MPO: mieloperoxidase; PAI: inibidores do ativador de plasminogênio; PNs: peptídeos natriuréticos; SNP: polimorfismos de nucleotídeo único; TE: tromboembolismo; TF: fator tecidual; TGF: fator de crescimento transformador; TIMP: inibidor tecidual da metaloproteinase; TM: trombomodulina; TNF: fator de necrose tumoral; TnT: troponina T.
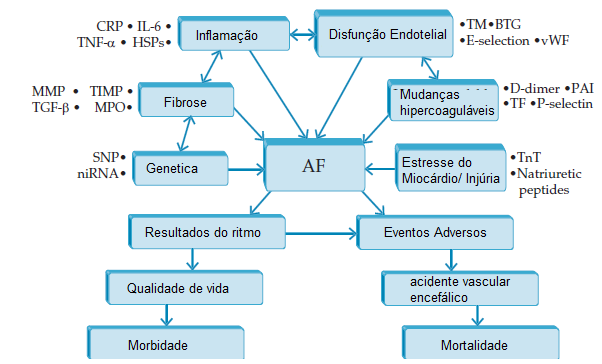
Figura 7 - Biomarcadores envolvidos na patogênese complexa da FA.
Fonte: Kornej J. e colaboradores, com permissão da Elsevier.163
DÍSTICOS DA FIGURA 7
|
CRP • IL-6 • TNF-a • HSPs |
= |
CRP • IL-6 • TNF-a • HSPs
|
|
Inflamation |
= |
Inflamação
|
|
Endothelial dysfuntion/damage |
= |
Disfunção/dano endotelial
|
|
• TM • BTG • E-selection • vWF |
= |
• TM • BTG •seleção-E • FvW
|
|
MMP • TIMP • TGF-ß • MPO |
= |
MMP • TIMP • TGF-ß • MPO
|
|
Fibrosis |
= |
Fibrose
|
|
Hypercoagulable changes |
= |
Alterações hipercoaguláveis
|
|
• D-dimer • PAI • TF • P-selectin |
= |
• Dímero-D • PAI • TF • selectina-P
|
|
SNP • miRNA • |
= |
SNP • miRNA •
|
|
Genetics |
= |
Genética
|
|
AF |
= |
FA
|
|
Myocardial stress/injury |
= |
Estresse/lesão miocárdica
|
|
• TnT • natriuretic peptides |
= |
• TnT • PNs
|
|
Rythm outcomes |
= |
Resultados do ritmo
|
|
Adverse events |
= |
Eventos adversos
|
|
Quality of life |
= |
Qualidade de vida
|
|
Stroke/TE |
= |
AVC/TE
|
|
Morbidity |
= |
Morbidade
|
|
Mortality |
= |
Mortalidade
|
Peptídeos natriuréticos
Rotineiramente, as concentrações de BNP e de NT-proBNP são mais elevadas em pacientes com FA em comparação com controles comuns,165 e acredita-se que o átrio seja a fonte de liberação de PNs.166 Dados recentes de exames do MR-proANP sugerem que esse tipo de peptídeo tem níveis elevados semelhantes causados pela FA em comparação com os peptídeos tipo-B.12,167
Ainda não está suficientemente claro se a liberação de BNP, de NT-proBNP ou de MR-proANP reflete o estresse do miocárdio atrial ou de algum outro tipo de mecanismo, ainda que, em geral, as concentrações de cada um desses peptídeos estejam na “faixa de IC”, na ausência de descompensação clinicamente óbvia da IC.
Prognóstico
Os PNs têm sido estudados em testes de grande porte envolvendo pacientes com FA para avaliar a capacidade de prever o risco de tromboembolismo (TE) e de morte cardiovascular.168,169
Por exemplo, em uma análise que envolveu 14.892 pacientes no teste Apixaban for the Prevention of Stroke in Subjects with Atrial Fibrillation (Aristotle), descobriu-se que os pacientes do quartil mais alto de concentrações de NT-proBNP (>1.250ng/L) tinham uma taxa anual de AVC/embolia sistêmica de 2,21%, em comparação com 0,74% no quartil mais baixo (=363ng/L) com HR de 2,35 (IC 95%, 1,62?3,40; p <0,0001) em um período de 18 anos de acompanhamento.169
A taxa anual de morte cardiovascular foi de 4,14% no quartil mais alto e de 0,86% no quartil mais baixo (HR de 2,50; IC 95%, 1,81?3,45; p <0,0001). Além disso, a adição de NT-proBNP à pontuação CHA2DS2-VASC melhorou significativamente a estatística-C para AVC/embolia sistêmica e morte cardíaca. Resultados semelhantes foram encontrados no teste Randomized Evaluation of Long-Term Antigoagulation (RE-LY).168
Embora a razão pela qual esses peptídeos permitem prever a presença de complicações embólicas ainda permaneça no campo das especulações, o estabelecimento de um vínculo entre a gravidade da doença cardiovascular estrutural e o risco de AVC,170 e o vínculo entre os PNs e a gravidade da doença cardíaca subjacente (com ou sem IC óbvia), provavelmente explique sua capacidade para prever a ocorrência de eventos embólicos.
Recorrência de fibrilação atrial
A concentração dos PNs em pacientes com FA, ao que tudo indica, diminuiu após a recuperação do ritmo sinusal com cardioversão ou com ablação de cateter com radiofrequência.171,172 No entanto, é necessária uma quantidade maior de dados antes de se definir um papel para os PNs na previsão de recorrência de FA.
Fibrilação atrial incidente
Diversos estudos mostraram que o BNP e o NT-proBNP são preditores de nova FA na comunidade.173,174 Por exemplo, o NT-proBNP foi investigado no Cardiovascular Health Study em cerca de 5 mil pacientes, sendo que concentrações de NT-proBNP acima de 290,3pg/mL tinham um risco substancial de FA após o ajuste para fatores de risco clínicos e ecocardiográficos relevantes com HR de 4,0 (IC 95%, 3,02?5,0; p <0,001).173
Troponina de alta sensibilidade
Prognóstico
Assim como nos resultados obtidos com o NT-proBNP, as concentrações do hsTnT foram avaliadas como preditoras de AVC/embolia sistêmica, morte cardiovascular e hemorragia em pacientes tratados no teste Aristotle. Em comparação com o quartil mais baixo de hsTnT (=7,5ng/L), os pacientes no quartil mais alto (>16,7ng/L) apresentaram um aumento significativo na taxa anual de AVC/embolia sistêmica (2,13 versus 0,87%; p = 0,001), morte cardíaca (4,24 versus 0,46%; p <0,0001) e hemorragia grave (4,21 versus 1,26%; p = 0,0001).
Verificou-se também que houve uma melhora na estatística-C nas pontuações de CHA2DS2-VASC com a adição de hsTnT para a previsão de AVC/embolia sistêmica e morte cardíaca.175 Resultados semelhantes foram observados com a hsTnT na mesma população de pacientes.176
Recorrência de fibrilação atrial
O uso da hsTnT não chegou a ser avaliado como preditor isolado de recorrência de FA, ainda que um estudo tenha examinado diversos biomarcadores em pacientes no teste GISSI-Atrial Fibrilation e concluiu que concentrações mais elevadas da hsTnT na linha de base (>73pg/mL) foram preditoras independentes da primeira recorrência de FA em análises ajustadas.177
Fibrilação atrial incidente
Embora os dados sobre o uso da Tn para prever novo início de FA sejam limitados, a hsTnI foi estudada com outros novos biomarcadores no Framingham Heart Study por sua importância para prever FA incidente em 3.217 pacientes. Em análises ajustadas, apenas a hsTnI (modelada como variável contínua) foi associada de forma significativa à FA após a correção para os fatores de risco convencionais para FA, BNP e CRP (HR 1,12; IC 95%, 1,00?1,26; p = 0,045).178
Proteína c-reativa
Prognóstico
Descobriu-se que os níveis de CRP são elevados em indivíduos com FA, sendo que os pacientes com FA persistente apresentaram concentrações mais elevadas, em comparação com aqueles com FA solitária.179 Levando-se em conta essa associação, a CRP passou a ser investigada por sua capacidade prognóstica.137,180
No teste Stroke Prevention in Atrial Fibrillation (Spaf) III, os pacientes com risco mais elevado de AVC, usando-se os critérios de risco do estudo Spaf III e o sistema de pontuação CHADS2, tinham concentrações mais elevadas de CRP; entretanto, embora a CRP fosse preditora de morte, não previa a ocorrência de AVC.180
Recorrência de fibrilação atrial
As medições da CRP foram também estudadas para ajudar a determinar o risco de recorrência de FA.181,182 Uma metanálise recente determinou que os processos de CRP moderam a capacidade de prever a recorrência de FA depois de uma cardioversão bem-sucedida com uma OR ajustada de 3,33 (IC 95%, 2,10?5,28; p = 0,045) com sensibilidade e especificidade de 71 e 72%, respectivamente.
A grande maioria dos estudos utilizou o resultado de uma CRP de 1,9mg/L para prever a recorrência de FA no longo prazo e de 3mg/L para prever a recorrência no curto prazo.182
Fibrilação atrial incidente
O uso da CRP para prever o desenvolvimento futuro de FA foi avaliado em 5.491 pacientes no Cardiovascular Health Study. Os pacientes foram acompanhados durante uma mediana de 7,8 anos, sendo que 16% deles desenvolveram FA durante o tempo de duração do estudo. A medição da CRP na linha de base foi considerada preditiva de desenvolvimento futuro de FA com uma HR ajustada de 1,31 (IC 95%, 1,08?1,58; p = 0,005) para o quarto quartil (>3,41mg/L) versus o primeiro quartil da CRP (<0,97mg/L).183
Biomarcadores para prever o risco de complicações trombóticas em fibrilação atrial
Além do uso de PNs, Tn e CRP na avaliação dos riscos de FA, é importante considerar o uso potencial dos biomarcadores de trombose para prever complicações causadas pela FA. Ainda que inúmeros marcadores da ativação de plaquetas (como as seletinas, por exemplo) e de coagulação (como o fator de von Willebrand [FvW]) estejam associados a evidências de estase no apêndice atrial e ao risco de complicações tromboembólicas,184,185 nenhum deles é suficientemente sensível ou específico para uso clínico.
Uma pergunta extremamente importante é se os biomarcadores podem ser usados para monitorar o risco de TE em pacientes que tiveram resolução da FA no contexto de descontinuação no uso de varfarina ou de terapias anticoagulantes mais modernas. Nesse aspecto, o foco recaiu sobre o uso de D-dímeros, um biomarcador que reflete a ruptura de trombos.
As concentrações dos dímeros-D aumentam no contexto de presença de trombos;186 alguns especialistas sugerem que qualquer elevação na concentração desse marcador após a interrupção da terapia anticoagulante poderá identificar pacientes com risco mais elevado de AVC.187 Entretanto, não existe nenhum teste prospectivo que tenha utilizado os dímeros-D que possa orientar o uso anticoagulante em casos de FA.
Conclusão
O campo de pesquisa sobre o uso de biomarcadores na cardiologia está expandindo rapidamente. Embora existam orientações bem definidas para alguns marcadores, como os PNs e a Tn, ainda são necessários mais estudos para esclarecer o uso apropriado desses biomarcadores já estabelecidos e dos novos biomarcadores que surgirão, com vistas a simplificar o diagnóstico, o prognóstico e o tratamento de pacientes nessas condições cardiovasculares tão complexas.
|
Informações financeiras: Parul U. Ghandi, MD, não tem relações financeiras relevantes a declarar. James L. Januzzi, MD, PhD, trabalhou como assessor e consultor para as empresas Critical Diagnostics, Roche, Jensen, Amgen, Novartis e Radiometer. Ele recebeu financiamento para pesquisas das empresas Critical Diagnostics, Roche, Thermo Fisher, Singulex e Siemens AG. |
Referências
1. Morrow DA, de Lemos JA. Benchmarks for the assessment of novel cardiovascular biomarkers. Circulation 2007;115:949–52.
2. Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics—2014 update: a report from the American Heart Association. Circulation 2014;129:e28–292.
3. Takei Y. Exploring novel hormones essential for seawater adaptation in teleost fish. Gen Comp Endocrinol 2008;157:3–13.
4. de Bold AJ, Borenstein HB, Veress AT, Sonnenberg H. A rapid and potent natriuretic response to intravenous injection of atrial myocardial extract in rats. Life Sci 1981;28:89–94.
5. Sudoh T, Kangawa K, Minamino N, Matsuo H. A new natriuretic peptide in porcine brain. Nature 1988;332:78–81.
6. Kinnunen P, Vuolteenaho O, Ruskoaho H. Mechanisms of atrial and brain natriuretic peptide release from rat ventricular myocardium: effect of stretching. Endocrinology 1993;132:1961–70.
7. Munagala VK, Burnett JC Jr, Redfield MM. The natriuretic peptides in cardiovascular medicine. Curr Probl Cardiol 2004;29:707–69.
8. Dries DL, Ky B, Wu AH, et al. Simultaneous assessment of unprocessed ProBNP1-108 in addition to processed BNP32 improves identification of high-risk ambulatory patients with heart failure. Circ Heart Fail 2010;3:220–7.
9. Martinez-Rumayor A, Richards AM, Burnett JC, Januzzi JL Jr. Biology of the natriuretic peptides. Am J Cardiol 2008;101:3–8.
10. Morgenthaler NG, Struck J, Thomas B, Bergmann A. Immunoluminometric assay for the midregion of pro-atrial natriuretic peptide in human plasma. Clin Chem 2004;50:234–6.
11. Maisel A, Mueller C, Nowak R, et al. Mid-region pro-hormone markers for diagnosis and prognosis in acute dyspnea: results from the BACH (Biomarkers in Acute Heart Failure) trial. J Am Coll Cardiol 2010;55:2062–76.
12. Shah RV, Truong QA, Gaggin HK, et al. Mid-regional pro-atrial natriuretic peptide and pro-adrenomedullin testing for the diagnostic and prognostic evaluation of patients with acute dyspnoea. Eur Heart J 2012;33:2197–205.
13. Maisel AS, Krishnaswamy P, Nowak RM, et al. Rapid measurement of B-type natriuretic peptide in the emergency diagnosis of heart failure. N Engl J Med 2002;347:161–7.
14. Januzzi JL Jr, Camargo CA, Anwaruddin S, et al. The N-terminal Pro-Bnp investigation of Dyspnea in the Emergency Department (PRIDE) study. Am J Cardiol 2005;95:948–54.
15. van Kimmenade RR, Pinto YM, Januzzi JL Jr. Importance and interpretation of intermediate (gray zone) amino-terminal pro-B-type natriuretic peptide concentrations. Am J Cardiol 2008;101:39–42.
16. Januzzi JL, van Kimmenade R, Lainchbury J, et al. NT-proBNP testing for diagnosis and short-term prognosis in acute destabilized heart failure: an international pooled analysis of 1256 patients: the International Collaborative of NT-proBNP Study. Eur Heart J 2006;27:330–7.
17. Das SR, Drazner MH, Dries DL, et al. Impact of body mass and body composition on circulating levels of natriuretic peptides: results from the Dallas Heart Study. Circulation 2005;112:2163–8.
18. Raymond I, Groenning BA, Hildebrandt PR, et al. The influence of age, sex and other variables on the plasma level of N-terminal pro brain natriuretic peptide in a large sample of the general population. Heart 2003;89:745–51.
19. Maisel A, Mueller C, Adams K Jr, et al. State of the art: using natriuretic peptide levels in clinical practice. Eur J Heart Fail 2008;10:824–39.
20. Wu AH. Serial testing of B-type natriuretic peptide and NTpro-BNP for monitoring therapy of heart failure: the role of biologic variation in the interpretation of results. Am Heart J 2006;152:828–34.
21. Fuat A, Murphy JJ, Hungin AP, et al. The diagnostic accuracy and utility of a B-type natriuretic peptide test in a community population of patients with suspected heart failure. Br J Gen Pract 2006;56:327–33.
22. Hildebrandt P, Collinson PO. Amino-terminal pro-B-type natriuretic peptide testing to assist the diagnostic evaluation of heart failure in symptomatic primary care patients. Am J Cardiol 2008;101:25–8.
23. Owan TE, Hodge DO, Herges RM, et al. Trends in prevalence and outcome of heart failure with preserved ejection fraction. N Engl J Med 2006;355:251–9.
24. Steinberg BA, Zhao X, Heidenreich PA, et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation 2012;126:65–75.
25. Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines. Circulation 2013;128:e240–327.
26. Januzzi JL Jr, Rehman S, Mueller T, et al. Importance of biomarkers for long-term mortality prediction in acutely dyspneic patients. Clin Chem 2010;56:1814–21.
27. Januzzi JL Jr, Sakhuja R, O’Donoghue M, et al. Utility of amino-terminal pro-brain natriuretic peptide testing for prediction of 1-year mortality in patients with dyspnea treated in the emergency department. Arch Intern Med 2006;166:315–20.
28. Maisel A, Hollander JE, Guss D, et al. Primary results of the Rapid Emergency Department Heart Failure Outpatient Trial (REDHOT). A multicenter study of B-type natriuretic peptide levels, emergency department decision making, and outcomes in patients presenting with shortness of breath. J Am Coll Cardiol 2004;44:1328–33.
29. Kociol RD, Horton JR, Fonarow GC, et al. Admission, discharge, or change in B-type natriuretic peptide and long-term outcomes: data from Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF) linked to Medicare claims. Circ Heart Fail 2011;4:628–36.
30. Michtalik HJ, Yeh HC, Campbell CY, et al. Acute changes in N-terminal pro-B-type natriuretic peptide during hospitalization and risk of readmission and mortality in patients with heart failure. Am J Cardiol 2011;107:1191–5.
31. Doust JA, Pietrzak E, Dobson A, Glasziou P. How well does B-type natriuretic peptide predict death and cardiac events in patients with heart failure: systematic review. BMJ 2005;330:625.
32. Latini R, Masson S, Wong M, et al. Incremental prognostic value of changes in B-type natriuretic peptide in heart failure. Am J Med 2006;119:70 e23–30.
33. Masson S, Latini R, Anand IS, et al. Prognostic value of changes in N-terminal pro-brain natriuretic peptide in Val-HeFT (Valsartan Heart Failure Trial). J Am Coll Cardiol 2008;52:997–1003.
34. Motiwala SR, Januzzi JL Jr. The role of natriuretic peptides as biomarkers for guiding the management of chronic heart failure. Clin Pharmacol Ther 2013;93:57–67.
35. Troughton RW, Frampton CM, Yandle TG, et al. Treatment of heart failure guided by plasma aminoterminal brain natriuretic peptide (N-BNP) concentrations. Lancet 2000;355:1126–30.
36. Felker GM, Hasselblad V, Hernandez AF, O’Connor CM. Biomarker-guided therapy in chronic heart failure: a meta-analysis of randomized controlled trials. Am Heart J 2009;158:422–30.
37. Porapakkham P, Porapakkham P, Zimmet H, et al. B-type natriuretic peptide-guided heart failure therapy: a meta-analysis. Arch Intern Med 2010;170:507–14.
38. Savarese G, Trimarco B, Dellegrottaglie S, et al. Natriuretic peptide-guided therapy in chronic heart failure: a meta-analysis of 2,686 patients in 12 randomized trials. PLoS One 2013;8:e58287.
39. Bhardwaj A, Rehman SU, Mohammed AA, et al. Quality of life and chronic heart failure therapy guided by natriuretic peptides: results from the ProBNP Outpatient Tailored Chronic Heart Failure Therapy (PROTECT) study. Am Heart J 2012;164:793–9 e1.
40. Weiner RB, Baggish AL, Chen-Tournoux A, et al. Improvement in structural and functional echocardiographic parameters during chronic heart failure therapy guided by natriuretic peptides: mechanistic insights from the ProBNP Outpatient Tailored Chronic Heart Failure (PROTECT) study. Eur J Heart Fail 2013;15:342–51.
41. Adlbrecht C, Huelsmann M, Berger R, et al. Cost analysis and cost-effectiveness of NT-proBNP-guided heart failure specialist care in addition to home-based nurse care. Eur J Clin Invest 2011;41:315–22.
42. Sanders-van Wijk S, van Asselt AD, Rickli H, et al. Cost-effectiveness of N-terminal pro-B-type natriuretic-guided therapy in elderly heart failure patients: results from TIME-CHF (Trial of Intensified versus Standard Medical Therapy in Elderly Patients with Congestive Heart Failure). JACC Heart Fail 2013;1:64–71.
43. Sanders-van Wijk S, Muzzarelli S, Neuhaus M, et al. Safety and tolerability of intensified, N-terminal pro brain natriuretic peptide-guided compared with standard medical therapy in elderly patients with congestive heart failure: results from TIME-CHF. Eur J Heart Fail 2013;15:910–8.
44. Redfield MM, Rodeheffer RJ, Jacobsen SJ, et al. Plasma brain natriuretic peptide to detect preclinical ventricular systolic or diastolic dysfunction: a community-based study. Circulation 2004;109:3176–81.
45. Vasan RS, Benjamin EJ, Larson MG, et al. Plasma natriuretic peptides for community screening for left ventricular hypertrophy and systolic dysfunction: the Framingham heart study. JAMA 2002;288:1252–9.
46. Wang TJ, Larson MG, Levy D, et al. Plasma natriuretic peptide levels and the risk of cardiovascular events and death. N Engl J Med 2004;350:655–63.
47. deFilippi CR, Christenson RH, Gottdiener JS, et al. Dynamic cardiovascular risk assessment in elderly people. The role of repeated N-terminal pro-B-type natriuretic peptide testing. J Am Coll Cardiol 2010;55:441–50.
48. Ledwidge M, Gallagher J, Conlon C, et al. Natriuretic peptide-based screening and collaborative care for heart failure: the STOP-HF randomized trial. JAMA 2013;310:66–74.
49. Huelsmann M, Neuhold S, Resl M, et al. PONTIAC (NT-proBNP selected prevention of cardiac events in a population of diabetic patients without a history of cardiac disease): a prospective randomized controlled trial. J Am Coll Cardiol 2013;62:1365–72.
50. deFilippi CR, de Lemos JA, Tkaczuk AT, et al. Physical activity, change in biomarkers of myocardial stress and injury, and subsequent heart failure risk in older adults. J Am Coll Cardiol 2012;60:2539–47.
51. Januzzi JL Jr, Filippatos G, Nieminen M, Gheorghiade M. Troponin elevation in patients with heart failure: on behalf of the third Universal Definition of Myocardial Infarction Global Task Force: Heart Failure Section. Eur Heart J 2012;33:2265–71.
52. Kociol RD, Pang PS, Gheorghiade M, et al. Troponin elevation in heart failure: prevalence, mechanisms, and clinical implications. J Am Coll Cardiol 2010;56:1071–8.
53. Peacock WFT, De Marco T, Fonarow GC, et al. Cardiac troponin and outcome in acute heart failure. N Engl J Med 2008;358:2117–26.
54. Pascual-Figal DA, Casas T, Ordonez-Llanos J, et al. Highly sensitive troponin T for risk stratification of acutely destabilized heart failure. Am Heart J 2012;163:1002–10.
55. Xue Y, Clopton P, Peacock WF, Maisel AS. Serial changes in high-sensitive troponin I predict outcome in patients with decompensated heart failure. Eur J Heart Fail 2011;13:37–42.
56. Latini R, Masson S, Anand IS, et al. Prognostic value of very low plasma concentrations of troponin T in patients with stable chronic heart failure. Circulation 2007;116:1242–9.
57. Masson S, Anand I, Favero C, et al. Serial measurement of cardiac troponin T using a highly sensitive assay in patients with chronic heart failure: data from 2 large randomized clinical trials. Circulation 2012;125:280–8.
58. Horwich TB, Patel J, MacLellan WR, Fonarow GC. Cardiac troponin I is associated with impaired hemodynamics, progressive left ventricular dysfunction, and increased mortality rates in advanced heart failure. Circulation 2003;108:833–8.
59. Perna ER, Aspromonte N, Cimbaro Canella JP, et al. Minor myocardial damage is a prevalent condition in patients with acute heart failure syndromes and preserved systolic function with long-term prognostic implications: a report from the CIAST-HF (Collaborative Italo-Argentinean Study on cardiac Troponin T in Heart Failure) study. J Card Fail 2012;18:822–30.
60. Daniels LB, Laughlin GA, Clopton P, et al. Minimally elevated cardiac troponin T and elevated N-terminal pro-B-type natriuretic peptide predict mortality in older adults: results from the Rancho Bernardo Study. J Am Coll Cardiol 2008;52:450–9.
61. Saunders JT, Nambi V, de Lemos JA, et al. Cardiac troponin T measured by a highly sensitive assay predicts coronary heart disease, heart failure, and mortality in the Atherosclerosis Risk in Communities Study. Circulation 2011;123:1367–76.
62. de Lemos JA, Drazner MH, Omland T, et al. Association of troponin T detected with a highly sensitive assay and cardiac structure and mortality risk in the general population. JAMA 2010;304:2503–12.
63. Glick D, Defilippi CR, Christenson R, et al. Long-term trajectory of two unique cardiac biomarkers and subsequent left ventricular structural pathology and risk of incident heart failure in community-dwelling older adults at low baseline risk. JACC Heart Fail 2013;1:353–60.
64. Wang TJ, Wollert KC, Larson MG, et al. Prognostic utility of novel biomarkers of cardiovascular stress: the Framingham Heart Study. Circulation 2012;126:1596–604.
65. Weinberg EO, Shimpo M, Hurwitz S, et al. Identification of serum soluble ST2 receptor as a novel heart failure biomarker. Circulation 2003;107:721–6.
66. Sanada S, Hakuno D, Higgins LJ, et al. IL-33 and ST2 comprise a critical biomechanically induced and cardioprotective signaling system. J Clin Invest 2007;117:1538–49.
67. Sharma UC, Pokharel S, van Brakel TJ, et al. Galectin-3 marks activated macrophages in failure-prone hypertrophied hearts and contributes to cardiac dysfunction. Circulation 2004;110:3121–8.
68. Henry-Okafor Q, Collins SP, Jenkins CA, et al. Soluble ST2 as a diagnostic and prognostic marker for acute heart failure syndromes. Open Biomark J 2012;2012:1–8.
69. van Kimmenade RR, Januzzi JL Jr, Ellinor PT, et al. Utility of amino-terminal pro-brain natriuretic peptide, galectin-3, and apelin for the evaluation of patients with acute heart failure. J Am Coll Cardiol 2006;48:1217–24.
70. Januzzi JL Jr, Peacock WF, Maisel AS, et al. Measurement of the interleukin family member ST2 in patients with acute dyspnea: results from the PRIDE (Pro-Brain Natriuretic Peptide Investigation of Dyspnea in the Emergency Department) study. J Am Coll Cardiol 2007;50:607–13.
71. Lassus J, Gayat E, Mueller C, et al. Incremental value of biomarkers to clinical variables for mortality prediction in acutely decompensated heart failure: the Multinational Observational Cohort on Acute Heart Failure (MOCA) study. Int J Cardiol 2013;168:2186–94.
72. Manzano-Fernandez S, Januzzi JL, Pastor-Perez FJ, et al. Serial monitoring of soluble interleukin family member ST2 in patients with acutely decompensated heart failure. Cardiology 2012;122:158–66.
73. Shah RV, Chen-Tournoux AA, Picard MH, et al. Galectin-3, cardiac structure and function, and long-term mortality in patients with acutely decompensated heart failure. Eur J Heart Fail 2010;12:826–32.
74. Felker GM, Fiuzat M, Thompson V, et al. Soluble ST2 in ambulatory patients with heart failure: association with functional capacity and long-term outcomes. Circ Heart Fail 2013;6:1172–9.
75. Ky B, French B, McCloskey K, et al. High-sensitivity ST2 for prediction of adverse outcomes in chronic heart failure. Circ Heart Fail 2011;4:180–7.
76. Gaggin HK, Szymonifka J, Bhardwaj A, et al. Head-to-head comparison of serial soluble ST2, growth differentiation factor-15, and highly-sensitive troponin T measurements in patients with chronic heart failure. JACC Heart Fail 2014;2:65–72.
77. van der Velde AR, Gullestad L, Ueland T, et al. Prognostic value of changes in galectin-3 levels over time in patients with heart failure: data from CORONA and COACH. Circ Heart Fail 2013;6:219–26.
78. Motiwala SR, Szymonifka J, Belcher A, et al. Serial measurement of galectin-3 in patients with chronic heart failure: results from the ProBNP Outpatient Tailored Chronic Heart Failure Therapy (PROTECT) study. Eur J Heart Fail 2013;15:1157–63.
79. Bayes-Genis A, de Antonio M, Vila J, et al. Head-to-head comparison of 2 myocardial fibrosis biomarkers for long-term heart failure risk stratification: ST2 versus galectin-3. J Am Coll Cardiol 2014;63:158–66.
80. Januzzi JL Jr, van Kimmenade RR. Importance of rigorous evaluation in comparative biomarker studies. J Am Coll Cardiol 2014;63:167–9.
81. Gaggin HK, Motiwala S, Bhardwaj A, et al. Soluble concentrations of the interleukin receptor family member ST2 and beta-blocker therapy in chronic heart failure. Circ Heart Fail 2013;6:1206–13.
82. Anand IS, Rector TS, Kuskowski M, et al. Prognostic value of soluble ST2 in the Valsartan Heart Failure Trial. Circ Heart Fail 2014. DOI: 10.1161/CIRCHEARTFAILURE.113.001036. [Epub ahead of print]
83. Gullestad L, Ueland T, Kjekshus J, et al. Galectin-3 predicts response to statin therapy in the Controlled Rosuvastatin Multinational Trial in Heart Failure (CORONA). Eur Heart J 2012;33:2290–6.
84. Ho JE, Liu C, Lyass A, et al. Galectin-3, a marker of cardiac fibrosis, predicts incident heart failure in the community. J Am Coll Cardiol 2012;60:1249–56.
85. Lloyd-Jones D, Adams RJ, Brown TM, et al. Heart disease and stroke statistics—2010 update: a report from the American Heart Association. Circulation 2010;121:e46–215.
86. Lloyd-Jones DM, Larson MG, Beiser A, Levy D. Lifetime risk of developing coronary heart disease. Lancet 1999;353:89–92.
87. Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics—2013 update: a report from the American Heart Association. Circulation 2013;127:e6–245.
88. Adams JE 3rd, Bodor GS, Davila-Roman VG, et al. Cardiac troponin I. A marker with high specificity for cardiac injury. Circulation 1993;88:101–6.
89. Jaffe AS, Vasile VC, Milone M, et al. Diseased skeletal muscle: a noncardiac source of increased circulating concentrations of cardiac troponin T. J Am Coll Cardiol 2011;58:1819–24.
90. Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. Circulation 2012;126:2020–35.
91. de Lemos JA. Increasingly sensitive assays for cardiac troponins: a review. JAMA 2013;309:2262–9.
92. Apple FS, Collinson PO; IFCC Task Force on Clinical Applications of Cardiac Biomarkers. Analytical characteristics of high-sensitivity cardiac troponin assays. Clin Chem 2012;58:54–61.
93. Conrad MJ, Jarolim P. Cardiac troponins and high-sensitivity cardiac troponin assays. Clin Lab Med 2014;34:59–73.
94. Morrow DA, Cannon CP, Jesse RL, et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines: clinical characteristics and utilization of biochemical markers in acute coronary syndromes. Clin Chem 2007;53:552–74.
95. Macrae AR, Kavsak PA, Lustig V, et al. Assessing the requirement for the 6-hour interval between specimens in the American Heart Association Classification of Myocardial Infarction in Epidemiology and Clinical Research Studies. Clin Chem 2006;52:812–8.
96. Newby LK, Jesse RL, Babb JD, et al. ACCF 2012 expert consensus document on practical clinical considerations in the interpretation of troponin elevations: a report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol 2012;60:2427–63.
97. Keller T, Zeller T, Ojeda F, et al. Serial changes in highly sensitive troponin I assay and early diagnosis of myocardial infarction. JAMA 2011;306:2684–93.
98. Reichlin T, Hochholzer W, Bassetti S, et al. Early diagnosis of myocardial infarction with sensitive cardiac troponin assays. N Engl J Med 2009;361:858–67.
99. de Lemos JA, Morrow DA, deFilippi CR. Highly sensitive troponin assays and the cardiology community: a love/hate relationship? Clin Chem 2011;57:826–9.
100. Body R, Carley S, McDowell G, et al. Rapid exclusion of acute myocardial infarction in patients with undetectable troponin using a high-sensitivity assay. J Am Coll Cardiol 2011;58:1332–9.
101. Lindahl B, Diderholm E, Lagerqvist B, et al. FRISC II(Fast Revascularization during InStability in CAD) Investigators. Mechanisms behind the prognostic value of troponin T in unstable coronary artery disease: a FRISC II substudy. J Am Coll Cardiol 2001;38:979–86.
102. Wong GC, Morrow DA, Murphy S, et al. Elevations in troponin T and I are associated with abnormal tissue level perfusion: a TACTICS-TIMI 18 substudy. Treat Angina with Aggrastat and Determine Cost of Therapy with an Invasive or Conservative Strategy-Thrombolysis in Myocardial Infarction. Circulation 2002;106:202–7.
103. Ottani F, Galvani M, Nicolini FA, et al. Elevated cardiac troponin levels predict the risk of adverse outcome in patients with acute coronary syndromes. Am Heart J 2000;140:917–27.
104. Lindahl B, Venge P, James S. The new high-sensitivity cardiac troponin T assay improves risk assessment in acute coronary syndromes. Am Heart J 2010;160:224–9.
105. Bohula May EA, Bonaca MP, Jarolim P, et al. Prognostic performance of a high-sensitivity cardiac troponin I assay in patients with non-ST-elevation acute coronary syndrome. Clin Chem 2014;60:158–64.
106. Giannitsis E, Steen H, Kurz K, et al. Cardiac magnetic resonance imaging study for quantification of infarct size comparing directly serial versus single time-point measurements of cardiac troponin T. J Am Coll Cardiol 2008;51:307–14.
107. Heeschen C, Hamm CW, Goldmann B, et al. Troponin concentrations for stratification of patients with acute coronary syndromes in relation to therapeutic efficacy of tirofiban. PRISM Study Investigators. Platelet Receptor Inhibition in Ischemic Syndrome Management. Lancet 1999;354:1757–62.
108. Morrow DA, Antman EM, Tanasijevic M, et al. Cardiac troponin I for stratification of early outcomes and the efficacy of enoxaparin in unstable angina: a TIMI-11B substudy. J Am Coll Cardiol 2000;36:1812–7.
109. Simoons ML; GUSTO IV-ACS Investigators. Effect of glycoprotein IIb/IIIa receptor blocker abciximab on outcome in patients with acute coronary syndromes without early coronary revascularisation: the GUSTO IV-ACS randomised trial. Lancet 2001;357:1915–24.
110. Mehta SR, Cannon CP, Fox KA, et al. Routine vs selective invasive strategies in patients with acute coronary syndromes: a collaborative meta-analysis of randomized trials. JAMA 2005;293:2908–17.
111. O’Donoghue M, Boden WE, Braunwald E, et al. Early invasive vs conservative treatment strategies in women and men with unstable angina and non-ST-segment elevation myocardial infarction: a meta-analysis. JAMA 2008;300:71–80.
112. Zethelius B, Johnston N, Venge P. Troponin I as a predictor of coronary heart disease and mortality in 70-year-old men: a community-based cohort study. Circulation 2006;113:1071–8.
113. Lewandrowski K, Chen A, Januzzi JL. Cardiac biomarkers for myocardial infarction. Am J Clin Pathol 2002;118(Suppl):S93–9.
114. Morita E, Yasue H, Yoshimura M, et al. Increased plasma levels of brain natriuretic peptide in patients with acute myocardial infarction. Circulation 1993;88:82–91.
115. Truong QA, Bayley J, Hoffmann U, et al. Multi-marker strategy of natriuretic peptide with either conventional or high-sensitivity troponin-T for acute coronary syndrome diagnosis in emergency department patients with chest pain: from the “Rule Out Myocardial Infarction using Computer Assisted Tomography” (ROMICAT) trial. Am Heart J 2012;163:972–9 e1.
116. Windhausen F, Hirsch A, Sanders GT, et al. N-terminal pro-brain natriuretic peptide for additional risk stratification in patients with non-ST-elevation acute coronary syndrome and an elevated troponin T: an Invasive versus Conservative Treatment in Unstable coronary Syndromes (ICTUS) substudy. Am Heart J 2007;153:485–92.
117. Morrow DA, de Lemos JA, Sabatine MS, et al. Evaluation of B-type natriuretic peptide for risk assessment in unstable angina/non-ST-elevation myocardial infarction: B-type natriuretic peptide and prognosis in TACTICS-TIMI 18. J Am Coll Cardiol 2003;41:1264–72.
118. Lindahl B, Lindback J, Jernberg T, et al. Serial analyses of N-terminal pro-B-type natriuretic peptide in patients with non-ST-segment elevation acute coronary syndromes: a Fragmin and fast Revascularisation during In Stability in Coronary artery disease (FRISC)-II substudy. J Am Coll Cardiol 2005;45:533–41.
119. Fertin M, Hennache B, Hamon M, et al. Usefulness of serial assessment of B-type natriuretic peptide, troponin I, and C-reactive protein to predict left ventricular remodeling after acute myocardial infarction (from the REVE-2 study). Am J Cardiol 2010;106:1410–6.
120. Morrow DA, de Lemos JA, Blazing MA, et al. Prognostic value of serial B-type natriuretic peptide testing during follow-up of patients with unstable coronary artery disease. JAMA 2005;294:2866–71.
121. Orn S, Manhenke C, Squire IB, et al. Plasma MMP-2, MMP-9 and N-BNP in long-term survivors following complicated myocardial infarction: relation to cardiac magnetic resonance imaging measures of left ventricular structure and function. J Card Fail 2007;13:843–9.
122. Grandin EW, Jarolim P, Murphy SA, et al. Galectin-3 and the development of heart failure after acute coronary syndrome: pilot experience from PROVE IT-TIMI 22. Clin Chem 2012;58:267–73.
123. Kohli P, Bonaca MP, Kakkar R, et al. Role of ST2 in non-ST-elevation acute coronary syndrome in the MERLIN-TIMI 36 trial. Clin Chem 2012;58:257–66.
124. Sabatine MS, Morrow DA, Higgins LJ, et al. Complementary roles for biomarkers of biomechanical strain ST2 and N-terminal prohormone B-type natriuretic peptide in patients with ST-elevation myocardial infarction. Circulation 2008;117:1936–44.
125. James SK, Lindahl B, Siegbahn A, et al. N-terminal pro-brain natriuretic peptide and other risk markers for the separate prediction of mortality and subsequent myocardial infarction in patients with unstable coronary artery disease: a Global Utilization of Strategies To Open occluded arteries (GUSTO)-IV substudy. Circulation 2003;108:275–81.
126. Pepys MB. C-reactive protein fifty years on. Lancet 1981;1:653–7.
127. Elster SK, Braunwald E, Wood HF. A study of C-reactive protein in the serum of patients with congestive heart failure. Am Heart J 1956;51:533–41.
128. Libby P. Inflammation in atherosclerosis. Nature 2002;420:868–74.
129. Ledue TB, Rifai N. Preanalytic and analytic sources of variations in C-reactive protein measurement: implications for cardiovascular disease risk assessment. Clin Chem 2003;49:1258–71.
130. Kushner I. The phenomenon of the acute phase response. Ann N Y Acad Sci 1982;389:39–48.
131. Koenig W. High-sensitivity C-reactive protein and atherosclerotic disease: from improved risk prediction to risk-guided therapy. Int J Cardiol 2013;168:5126–34.
132. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003;107:499–511.
133. James SK, Armstrong P, Barnathan E, et al. Troponin and C-reactive protein have different relations to subsequent mortality and myocardial infarction after acute coronary syndrome: a GUSTO-IV substudy. J Am Coll Cardiol 2003;41:916–24.
134. Sabatine MS, Morrow DA, Jablonski KA, et al. Prognostic significance of the Centers for Disease Control/American Heart Association high-sensitivity C-reactive protein cut points for cardiovascular and other outcomes in patients with stable coronary artery disease. Circulation 2007;115:1528–36.
135. Anand IS, Latini R, Florea VG, et al. C-reactive protein in heart failure: prognostic value and the effect of valsartan. Circulation 2005;112:1428–34.
136. Winbeck K, Poppert H, Etgen T, et al. Prognostic relevance of early serial C-reactive protein measurements after first ischemic stroke. Stroke 2002;33:2459–64.
137. Hermida J, Lopez FL, Montes R, et al. Usefulness of high-sensitivity C-reactive protein to predict mortality in patients with atrial fibrillation (from the Atherosclerosis Risk In Communities [ARIC] Study). Am J Cardiol 2012;109:95–9.
138. Khera A, McGuire DK, Murphy SA, et al. Race and gender differences in C-reactive protein levels. J Am Coll Cardiol 2005;46:464–9.
139. Ridker PM, Hennekens CH, Rifai N, et al. Hormone replacement therapy and increased plasma concentration of C-reactive protein. Circulation 1999;100:713–6.
140. Danesh J, Muir J, Wong YK, et al. Risk factors for coronary heart disease and acute-phase proteins. A population-based study. Eur Heart J 1999;20:954–9.
141. Gupta NK, de Lemos JA, Ayers CR, et al. The relationship between C-reactive protein and atherosclerosis differs on the basis of body mass index: the Dallas Heart Study. J Am Coll Cardiol 2012;60:1148–55.
142. Ndumele CE, Pradhan AD, Ridker PM. Interrelationships between inflammation, C-reactive protein, and insulin resistance. J Cardiometab Syndr 2006;1:190–6.
143. Biasucci LM, Koenig W, Mair J, et al. How to use C-reactive protein in acute coronary care. Eur Heart J 2013;34:3687–90.
144. He LP, Tang XY, Ling WH, et al. Early C-reactive protein in the prediction of long-term outcomes after acute coronary syndromes: a meta-analysis of longitudinal studies. Heart 2010;96:339–46.
145. Lindahl B, Toss H, Siegbahn A, et al. Markers of myocardial damage and inflammation in relation to long-term mortality in unstable coronary artery disease. FRISC Study Group. Fragmin during Instability in Coronary Artery Disease. N Engl J Med 2000;343:1139–47.
146. Mueller C, Buettner HJ, Hodgson JM, et al. Inflammation and long-term mortality after non-ST elevation acute coronary syndrome treated with a very early invasive strategy in 1042 consecutive patients. Circulation 2002;105:1412–5.
147. Biasucci LM, Liuzzo G, Grillo RL, et al. Elevated levels of C-reactive protein at discharge in patients with unstable angina predict recurrent instability. Circulation 1999;99:855–60.
148. Haverkate F, Thompson SG, Pyke SD, et al. Production of C-reactive protein and risk of coronary events in stable and unstable angina. European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study Group. Lancet 1997;349:462–6.
149. Thompson SG, Kienast J, Pyke SD, et al. Hemostatic factors and the risk of myocardial infarction or sudden death in patients with angina pectoris. European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study Group. N Engl J Med 1995;332:635–41.
150. Buckley DI, Fu R, Freeman M, et al. C-reactive protein as a risk factor for coronary heart disease: a systematic review and meta-analyses for the U.S. Preventive Services Task Force. Ann Intern Med 2009;151:483–95.
151. Danesh J, Wheeler JG, Hirschfield GM, et al. C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease. N Engl J Med 2004;350:1387–97.
152. Ridker PM, Cushman M, Stampfer MJ, et al. Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. N Engl J Med 1997;336:973–9.
153. Wilson PW, Pencina M, Jacques P, et al. C-reactive protein and reclassification of cardiovascular risk in the Framingham Heart Study. Circ Cardiovasc Qual Outcomes 2008;1:92–7.
154. Morrow DA, de Lemos JA, Sabatine MS, et al. Clinical relevance of C-reactive protein during follow-up of patients with acute coronary syndromes in the Aggrastat-to-Zocor Trial. Circulation 2006;114:281–8.
155. Ridker PM, Cannon CP, Morrow D, et al. C-reactive protein levels and outcomes after statin therapy. N Engl J Med 2005;352:20–8.
156. Ridker PM, Rifai N, Clearfield M, et al. Measurement of C-reactive protein for the targeting of statin therapy in the primary prevention of acute coronary events. N Engl J Med 2001;344:1959–65.
157. Ridker PM, Rifai N, Pfeffer MA, et al. Long-term effects of pravastatin on plasma concentration of C-reactive protein. The Cholesterol and Recurrent Events (CARE) Investigators. Circulation 1999;100:230–5.
158. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008;359:2195–207.
159. Ioannidis JP, Tzoulaki I. Minimal and null predictive effects for the most popular blood biomarkers of cardiovascular disease. Circ Res 2012;110:658–62.
160. Greenland P, Alpert JS, Beller GA, et al. 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2010;56:e50–103.
161. Go AS, Hylek EM, Phillips KA, et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001;285:2370–5.
162. Frustaci A, Chimenti C, Bellocci F, et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation 1997;96:1180–4.
163. Kornej J, Apostolakis S, Bollmann A, Lip GY. The emerging role of biomarkers in atrial fibrillation. Can J Cardiol 2013;29:1181–93.
164. Lip GY, Nieuwlaat R, Pisters R, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the Euro Heart Survey on Atrial Fibrillation. Chest 2010;137:263–72.
165. Ellinor PT, Low AF, Patton KK, et al. Discordant atrial natriuretic peptide and brain natriuretic peptide levels in lone atrial fibrillation. J Am Coll Cardiol 2005;45:82–6.
166. Inoue S, Murakami Y, Sano K, et al. Atrium as a source of brain natriuretic polypeptide in patients with atrial fibrillation. J Card Fail 2000;6:92–6.
167. Richards M, Di Somma S, Mueller C, et al. Atrial fibrillation impairs the diagnostic performance of cardiac natriuretic peptides in dyspneic patients: results from the BACH Study (Biomarkers in ACute Heart Failure). JACC Heart Fail 2013;1:192–9.
168. Hijazi Z, Oldgren J, Andersson U, et al. Cardiac biomarkers are associated with an increased risk of stroke and death in patients with atrial fibrillation: a Randomized Evaluation of Long-term Anticoagulation Therapy (RE-LY) substudy. Circulation 2012;125:1605–16.
169. Hijazi Z, Wallentin L, Siegbahn A, et al. N-terminal pro-B-type natriuretic peptide for risk assessment in patients with atrial fibrillation: insights from the ARISTOTLE Trial (Apixaban for the Prevention of Stroke in Subjects With Atrial Fibrillation). J Am Coll Cardiol 2013;61:2274–84.
170. Wann L, Curtis A, Ellenbogen K, et al. Management of patients with atrial fibrillation (compilation of 2006 ACCF/AHA/ESC and 2011 ACCF/AHA/HRS recommendations): a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines. Circulation 2013;127:1916–26.
171. Wozakowska-Kaplon B. Effect of sinus rhythm restoration on plasma brain natriuretic peptide in patients with atrial fibrillation. Am J Cardiol 2004;93:1555–8.
172. Yamada T, Murakami Y, Okada T, et al. Plasma atrial natriuretic peptide and brain natriuretic peptide levels after radiofrequency catheter ablation of atrial fibrillation. Am J Cardiol 2006;97:1741–4.
173. Patton KK, Ellinor PT, Heckbert SR, et al. N-terminal pro-B-type natriuretic peptide is a major predictor of the development of atrial fibrillation: the Cardiovascular Health Study. Circulation 2009;120:1768–74.
174. Patton KK, Heckbert SR, Alonso A, et al. N-terminal pro-B-type natriuretic peptide as a predictor of incident atrial fibrillation in the Multi-Ethnic Study of Atherosclerosis: the effects of age, sex and ethnicity. Heart 2013;99:1832–6.
175. Hijazi Z, Wallentin L, Siegbahn A, et al. High-sensitivity troponin T and risk stratification in patients with atrial fibrillation during treatment with apixaban or warfarin. J Am Coll Cardiol 2014;63:52–61.
176. Hijazi Z, Siegbahn A, Andersson U, et al. High-sensitivity troponin I for risk assessment in patients with atrial fibrillation: insights from the Apixaban for Reduction in Stroke and Other Thromboembolic Events in Atrial Fibrillation (ARISTOTLE) Trial. Circulation 2014;129:625–34.
177. Latini R, Masson S, Pirelli S, et al. Circulating cardiovascular biomarkers in recurrent atrial fibrillation: data from the GISSI-Atrial Fibrillation trial. J Intern Med 2011;269:160–71.
178. Rienstra M, Yin X, Larson MG, et al. Relation between soluble ST2, growth differentiation factor-15, and high-sensitivity troponin I and incident atrial fibrillation. Am Heart J 2014;167:109–15 e2.
179. Chung MK, Martin DO, Sprecher D, et al. C-reactive protein elevation in patients with atrial arrhythmias: inflammatory mechanisms and persistence of atrial fibrillation. Circulation 2001;104:2886–91.
180. Lip GY, Patel JV, Hughes E, Hart RG. High-sensitivity C-reactive protein and soluble CD40 ligand as indices of inflammation and platelet activation in 880 patients with nonvalvular atrial fibrillation: relationship to stroke risk factors, stroke risk stratification schema, and prognosis. Stroke 2007;38:1229–37.
181. Korantzopoulos P, Kalantzi K, Siogas K, Goudevenos JA. Long-term prognostic value of baseline C-reactive protein in predicting recurrence of atrial fibrillation after electrical cardioversion. Pacing Clin Electrophysiol 2008;31:1272–6.
182. Yo CH, Lee SH, Chang SS, et al. Value of high-sensitivity C-reactive protein assays in predicting atrial fibrillation recurrence: a systematic review and meta-analysis. BMJ Open 2014;4:e004418.
183. Aviles RJ, Martin DO, Apperson-Hansen C, et al. Inflammation as a risk factor for atrial fibrillation. Circulation 2003;108:3006–10.
184. Ammash N, Konik EA, McBane RD, et al. Left atrial blood stasis and von Willebrand factor-ADAMTS13 homeostasis in atrial fibrillation. Arteriosclerosis Thromb Vascular Biol 2011;31:2760–6.
185. Conway DS, Pearce LA, Chin BS, et al. Plasma von Willebrand factor and soluble P-selectin as indices of endothelial damage and platelet activation in 1321 patients with nonvalvular atrial fibrillation: relationship to stroke risk factors. Circulation 2002;106:1962–7.
186. Habara S, Dote K, Kato M, et al. Prediction of left atrial appendage thrombi in non-valvular atrial fibrillation. Eur Heart J 2007;28:2217–22.
187. Sadanaga T, Sadanaga M, Ogawa S. Evidence that D-dimer levels predict subsequent thromboembolic and cardiovascular events in patients with atrial fibrillation during oral anticoagulant therapy. J Am Coll Cardiol 2010;55:2225–31.
188. van Veldhuisen DJ, Linssen GC, Jaarsma T, et al. B-type natriuretic peptide and prognosis in heart failure patients with preserved and reduced ejection fraction. J Am Coll Cardiol 2013;61:1498–506.
189. Maisel AS, McCord J, Nowak RM, et al. Bedside B-type natriuretic peptide in the emergency diagnosis of heart failure with reduced or preserved ejection fraction. Results from the Breathing Not Properly Multinational Study. J Am Coll Cardiol 2003;41:2010–7.
190. O’Donoghue M, Chen A, Baggish AL, et al. The effects of ejection fraction on N-terminal ProBNP and BNP levels in patients with acute CHF: analysis from the ProBNP Investigation of Dyspnea in the Emergency Department (PRIDE) study. J Card Fail 2005;11(5 Suppl):S9–14.
191. Komajda M, Carson PE, Hetzel S, et al. Factors associated with outcome in heart failure with preserved ejection fraction: findings from the Irbesartan in Heart Failure with Preserved Ejection Fraction Study (I-PRESERVE). Circ Heart Fail 2011;4:27–35.
192. Manzano-Fernandez S, Mueller T, Pascual-Figal D, et al. Usefulness of soluble concentrations of interleukin family member ST2 as predictor of mortality in patients with acutely decompensated heart failure relative to left ventricular ejection fraction. Am J Cardiol 2011;107:259–67.
193. de Boer RA, Lok DJ, Jaarsma T, et al. Predictive value of plasma galectin-3 levels in heart failure with reduced and preserved ejection fraction. Ann Med 2011;43:60–8.
194. Shah MR, Califf RM, Nohria A, et al. The STARBRITE trial: a randomized, pilot study of B-type natriuretic peptide-guided therapy in patients with advanced heart failure. J Card Fail 2011;17:613–21.
195. Eurlings LW, van Pol PE, Kok WE, et al. Management of chronic heart failure guided by individual N-terminal pro-B-type natriuretic peptide targets: results of the PRIMA (Can PRo-brain-natriuretic peptide guided therapy of chronic heart failure IMprove heart fAilure morbidity and mortality?) study. J Am Coll Cardiol 2010;56:2090–100.
196. Persson H, Erntell H, Eriksson B, et al. Improved pharmacological therapy of chronic heart failure in primary care: a randomized Study of NT-proBNP Guided Management of Heart Failure—SIGNAL-HF (Swedish Intervention study—Guidelines and NT-proBNP AnaLysis in Heart Failure). Eur J Heart Fail 2010;12:1300–8.
197. Karlstrom P, Alehagen U, Boman K, Dahlstrom U; UPSTEP-study group. Brain natriuretic peptide-guided treatment does not improve morbidity and mortality in extensively treated patients with chronic heart failure: responders to treatment have a significantly better outcome. Eur J Heart Fail 2011;13:1096–103.
198. Pfisterer M, Buser P, Rickli H, et al. BNP-guided vs symptom-guided heart failure therapy: the Trial of Intensified vs Standard Medical Therapy in Elderly Patients With Congestive Heart Failure (TIME-CHF) randomized trial. JAMA 2009;301:383–92.
199. Lainchbury JG, Troughton RW, Strangman KM, et al. N-terminal pro-B-type natriuretic peptide-guided treatment for chronic heart failure: results from the BATTLESCARRED (NT-proBNP-Assisted Treatment To Lessen Serial Cardiac Readmissions and Death) trial. J Am Coll Cardiol 2009;55:53–60.
200. Jourdain P, Jondeau G, Funck F, et al. Plasma brain natriuretic peptide-guided therapy to improve outcome in heart failure: the STARS-BNP Multicenter Study. J Am Coll Cardiol 2007;49:1733–9.
201. Berger R, Moertl D, Peter S, et al. N-terminal pro-B-type natriuretic peptide-guided, intensive patient management in addition to multidisciplinary care in chronic heart failure: a 3-arm, prospective, randomized pilot study. J Am Coll Cardiol 2010;55:645–53.
202. Januzzi JL Jr, Rehman SU, Mohammed AA, et al. Use of amino-terminal pro-B-type natriuretic peptide to guide outpatient therapy of patients with chronic left ventricular systolic dysfunction. J Am Coll Cardiol 2011;58:1881–9.