Insuficiência Suprarrenal
Caso Clínico
Uma paciente do sexo feminino, 50 anos, branca, procura o serviço de emergência devido a emagrecimento de 10 kg em um ano, cansaço, fraqueza muscular proximal e desânimo há dois anos, com piora progressiva. Ela relatou escurecimento difuso da pele e episódios de diarreia há três dias, associado a dor abdominal. A paciente também apresenta hipotireoidismo primário em tratamento com levotiroxina.
Ao realizar exame físico, constata-se hipotensão postural, mucosas desidratadas e escurecimento de pele em áreas fotoexpostas (Fig. 31.1).
Os exames laboratoriais evidenciam leucograma com 9.170 leucócitos (4.440 neutrófilos/420 eosinófilos/3.480 linfócitos), sódio de 130 mEq/L (135-150), potássio de 8,2 mEq/L (3,5-5,0), creatinina de 1,71mg/dL (até 1,2), hormônio estimulador da tireoide (TSH) de 8,9 UI/mL (0,4-4,5), anticorpo antitireoperoxidase (anti-TPO) de 319UI/L (até 35), cortisolde 2,9 g/dL (4,3-22), hormônio adrenocorticotrófico (ACTH) de 2.166 pg/mL (10-52), renina maior do que 50 ng/mL/h (0,51-2,64), aldosterona menor do que 2,2 ng/dL (4-31), sulfato de de idroepiandrosterona (SDHEA) de 26,2 g/dL (18,9-205) e, na gasometria, consta acidose metabólica leve em compensação. O nível de anticorpo anti 21 hidroxilase é de 121 (1,0).
Pesquisa sérica de paracoccidioidomicose e histoplasmose forneceram resultados negativos, e verifica-se Mantoux não reator.
Na tomografia computadorizada (TC) de abdome superior, constatam-se glândulas suprarrenais normais.
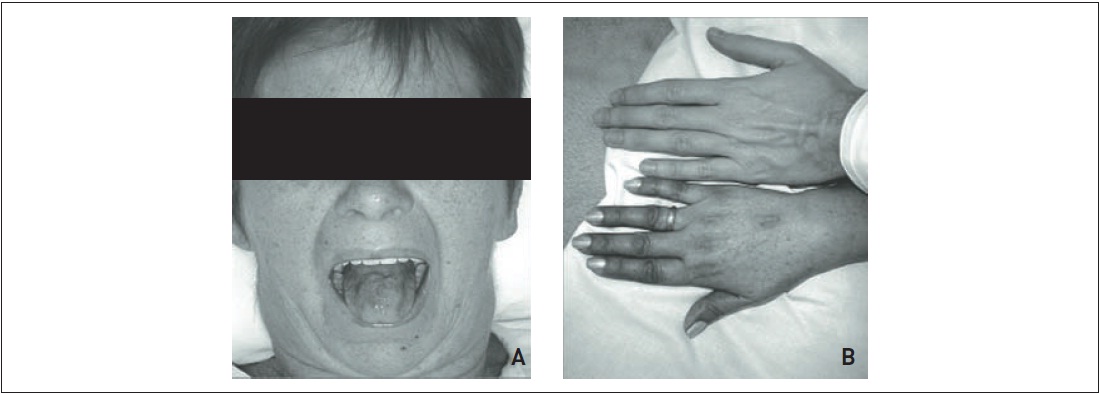
Figura 31.1
Paciente com quadro de insuficiência suprarrenal primária crônica, apresentando (A) hiperpigmentação da pele da face e (B) das mãos (comparar com mão do indivíduo saudável) e da mucosa oral.
Definição
As glândulas suprarrenais estão localizadas nos polos superiores dos rins no retroperitônio, pesando em média 2 g e medindo de 4 a 6 cm de comprimento (C) e de 2 a 3 cm de largura (L) (Fig. 31.2). Elas podem ser divididas em duas regiões, uma mais externa, o córtex, e outra interna, a medula, as quais diferem quanto à origem embriológica, ao tipo de hormônio produzido e ao mecanismo regulatório por que respondem.
O córtex, responsável pela síntese de hormônios esteroides, é constituído de três zonas distintas: a glomerulosa, mais externa, produtora de mineralocorticoides (principalmente aldosterona) que promovem retenção de sal; a fasciculada, envolvida na síntese de glicocorticoides (principalmente cortisol) com efeitos significativos sobre o metabolismo intermediário e a função imune; e a reticular, mais interna, encarregada dos hormônios com atividade androgênica (SDHEA). A regulação, a síntese e a secreção dos hormônios do córtex da suprarrenal têm origem no eixo hipotálamo-hipófise-suprarrenal (HHS), com exceção da aldosterona, que responde primariamente ao eixorenina-angiotensina (Fig. 31.3). Quando a secreção de hormônios do córtex da suprarrenal é inferior à adequada, seja em estado basal ou devido a estímulos estressores, decorrentes de destruição ou supressão do eixo HHS, há um quadro de insuficiência suprarrenal (IS).
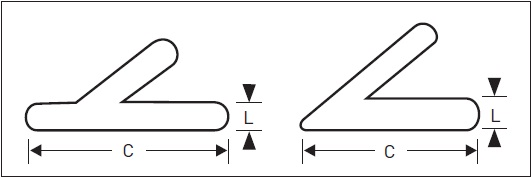
Figura 31.2
Tamanho e possíveis formas da glândula suprarrenal: peso médio de 2 g, 4 a 6 cm de comprimento (C) e 2 a 3 cm de largura (L).
Classificação
A insuficiência suprarrenal pode ser classificada como primária, secundária ou terciária. A primária, também denominada doença de Addison, em homenagem à Thomas Addison, que primeiramente a descreveu em 1855, ocorre quando a suprarrenal é incapaz de secretar os corticosteroides e os mineralocorticoides por uma destruição total do córtex suprarrenal.
A IS secundária ocorre quando há uma deficiência de hormônio adrenocorticotrófico (ACTH) hipofisário, e a terciária, quando a deficiência é de hormônio liberador de corticotrofina (CRH) hipotalâmico. Nesses dois últimos tipos de IS, também chamadas de insuficiência suprarrenal central, há perda do estímulo trófico das suprarrenais após algum tempo, mas somente a produção de corticosteroides estará comprometida, pois o eixorenina-angiotensina-aldosterona (RAA) mantém-se intacto, não afetando a produção de mineralocorticoide, que praticamente independe do ACTH.
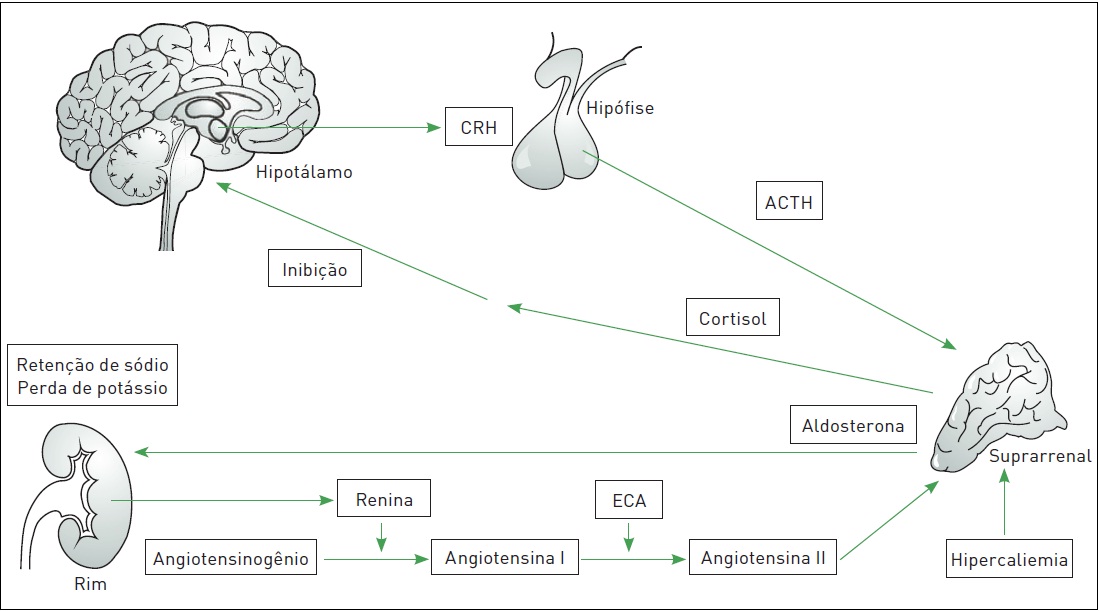
Figura 31.3
Regulação da produção de cortisol pelo eixo hipotálamo-hipófise-suprarrenal e da aldosterona pelo eixo renina-angiotensina-aldosterona.
CRH, hormônio liberador de corticotrofi na; ACTH, hormônio adrenocorticotrófico; ECA, enzima conversora da angiotensina.
Epidemiologia
Formas adquiridas de IS primária são relativamente raras, com uma prevalência de casos de 12/100.000 habitantes, e podem ocorrer em qualquer idade, com pico aos 40 anos (20 a 40 anos), sendo as mulheres mais frequentemente afetadas do que os homens (2,6:1). Em países desenvolvidos, a causa mais corriqueira de IS primária é a suprarrenalite autoimune. Já a IS central acaba sendo de incidência mais comum, devido ao frequente uso de esteroides em diversas modalidades terapêuticas, o que acarreta supressão do eixo HHS. Ela apresenta uma prevalência estimada de casos de 20/100.000 habitantes, afetando mais frequentemente as mulheres do que os ho- mens. O diagnóstico é realizado principalmente por volta dos 60 anos, e a principal causa é a suspensão abrupta da terapia com glicocorticoides.
Etiologia
As causas de IS estão listadas no Quadro 31.1.
Sinais e Sintomas
Os sinais e sintomas da IS manifestam-se conforme o grau de acometimento da função suprarrenal, o envolvimento ou não da função mineralocorticoide (afetando o balanço de água e sódio) e o grau de estresse existente (Quadro 31.2). O aparecimento dos sintomas ocorre geralmente de forma gradual e pode não ser percebido até que haja uma crise suprarrenal. A principal característica clínica que diferencia a IS primária da central é a pigmentação cutânea existente praticamente sempre na primeira, exceto quando a deficiência hormonal é de início recente, quando ainda não houve tempo para ocorrer esse evento. Há essa hiperpigmentação devido à redução do feedback negativo do cortisol, causando um aumento hipofisário da produção e clivagem da POMC (pró-ópio-melanocortina), um precursor de diversos peptídeos, entre eles o ACTH e o hormônio estimulador dos melanócitos. Observa-se hiperpigmentação em áreas fotoexpostas, axilas, mamilos, áreas de cicatrizes recentes, palma das mãos e mucosas (gengival, vaginal, anal). Outra diferença fundamental entre a IS primária e a secundária é o fato de que, nesta, não há envolvimento significativo do sistema RAA, pois esse sistema é regulado essencialmente pelos níveis séricos de potássio e pelo volume circulante efetivo. Dessa forma, praticamente não há alterações relacionadas aos distúrbios hidreletrolíticos e à volemia, como hipercaliemia e hipotensão postural grave. No entanto, pode haver hiponatremia dilucional causada por aumento da secreção da vasopressina, decorrente da deficiência de cortisol, e também hipotensão leve.
A crise suprarrenal é mais frequente na IS primária do que na secundária ou na terciária, pois há depleção de volume e hipotensão (consequência do defeito no sistema RAA) concomitante à perda de tônus vascular (falta de corticosteroides). É caracterizada por hipercaliemia, hiponatremia; perda urinária de sódio e depleção do volume plasmático com aumento da ureia.



Diagnóstico
A confirmação da IS inclui um processo dos três estágios a seguir:
1) Existe insuficiência suprarrenal? Para essa confirmação, é necessário demonstrar níveis de cortisol inapropriadamente baixos.
2) A insuficiência suprarrenal é primária ou secundária? Para a diferenciação, deve-se determinar se a deficiência de cortisol é causada pela deficiência de ACTH/ CRH ou por hipofunção primária da glândula (avaliar função mineralocorticoide).
3) Qual a etiologia da insuficiência suprarrenal? Nesse último estágio, procura-se a causa básica da doença.
Avaliação laboratorial
Um fluxograma para a investigação de IS é apresentado na figura 31.4.
Cortisol sérico. Um valor de cortisol sérico menor do que 3 g/dL é altamente sugestivo de IS com uma especificidade de 100%, mas com uma baixa sensibilidade (36%). Dessa forma, a dosagem isolada do cortisol matinal sérico não é um bom preditor de alteração na função suprarrenal e deve ser realizada junto a dosagem do ACTH. Valores basais de cortisol maiores do que 20 g/dL praticamente afastam o diagnóstico, assim como valores maiores do que 25 g/dL em vigência de estresse tornam o diagnóstico de IS improvável. Devem ser consideradas as possíveis interferências na dosagem de cortisol decorrentes de alteração na globulina carreadora de cortisol (CBG), como, por exemplo, a elevação da CBG devido ao uso de estrogênio oral, que provoca aumento dos níveis do cortisol total embora a fração livre permaneça inalterada.
Dosagem plasmática de ACTH. O nível de ACTH deve ser medido junto com o do cortisol sérico na avaliação inicial. Se o índice de cortisol for inapropriadamente baixo e o de ACTH for alto, diagnostica-se IS primária. Se ambos estiverem baixos, o paciente apresenta IS secundária ou terciária. Eventualmente, o resultado da dosagem de ACTH é demorado, e o paciente precisa realizar o diagnóstico de IS com mais brevidade. Nesses casos,realiza-se o teste de estimulação com ACTH intravenoso (cortrosina aquosa) na dose de 250 g. Deve-se ter o cuidado de coletar e centrifugar a amostra para ACTH em temperatura baixa para preservação do hormônio (tubo gelado).
Avaliação mineralocorticoide. Essa avaliação é realizada por meio da medida de potássio, sódio, renina e aldosterona plasmática. Na IS primária, a atividade ou concentração de renina está aumentada, e a aldosterona está reduzida. O nível de potássio pode estar elevado, e o de sódio, reduzido. Na IS secundária ou terciária, a renina e a aldosterona apresentam níveis normais, bem como o potássio sérico.
Anticorpos. A presença de anticorpos contra a 21-hi-droxilase, responsável pela primeira hidroxilação na formação de cortisol, pode ocorrer nos casos de suprar renalite autoimune. Confirmado o diagnóstico, deve-se estar atento para a presença de outras doenças autoimunes associadas, como tireoidite de Hashimoto, falência gonadal, diabetes melito tipo 1, anemia perniciosa e hipoparatireoidismo. O TSH pode estar elevado de forma moderada devido à deficiência do cortisol e é normalizado com a reposição do corticoide, não indicando necessariamente a presença de hipotireoidismo.
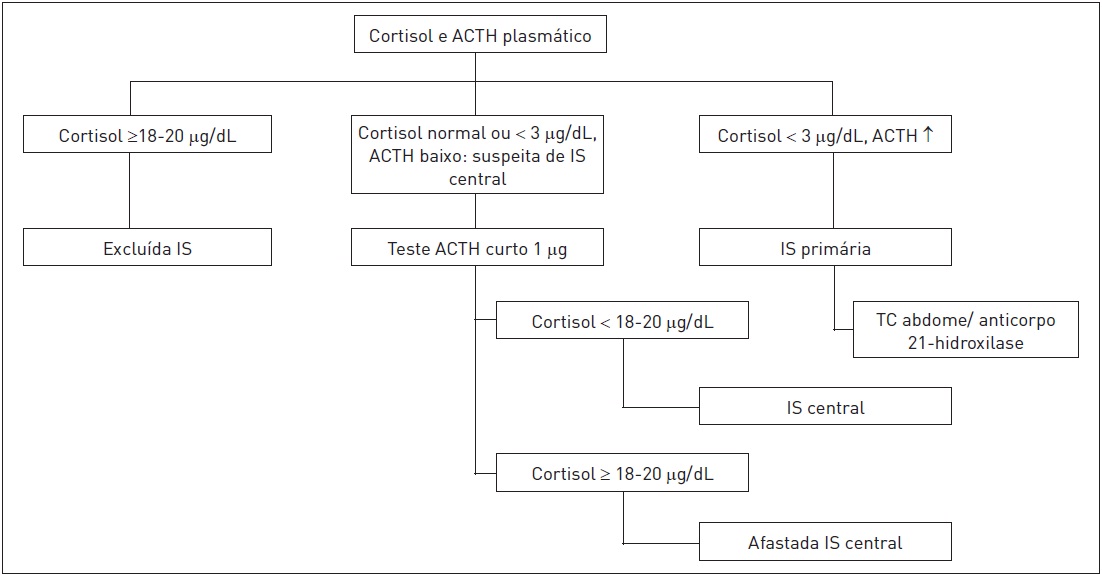
Figura 31.4
Investigação de insuficiência suprarrenal.
Testes de estimulação
Teste do ACTH curto/teste da cortrosina aquosa: Esse teste deve ser realizado nos pacientes em que o diagnóstico de IS está sendo considerado e naquelas situações em que não se dispõe de resultado rápido da dosagem de cortisol e ACTH plasmático. Não é necessária a realização desse teste se o paciente apresenta um cortisol matinal no limite superior da normalidade (> 20 g/dL). O teste é realizado por meio de injeção intravenosa de ACTH sintético de duas formas: com baixa dose de 1 g (dose mais fisiológica para suspeita de IS secundária), dosando-se o cortisol após 20 ou 30 minutos da injeção, ou com alta dose de 250 g (suspeita de IS primária), dosando-se o cortisol após 30 a 60 minutos. Ausência de resposta (cortisol < 18 g/dL) no teste com 250 g confirma IS primária, e essa ausência de resposta no teste de 1 g de ACTH sugere IS secundária (que poderia responder com teste de dose mais alta).
Teste da hipoglicemia insulínica: Na IS secundária ou terciária de início recente (p. ex., uma a duas semanas após cirurgia hipofisária), os testes de escolha são o de ACTH de baixa dosagem ou hipoglicemia insulínica. Nesses casos, as suprarrenais ainda não estão completamente atrofiadas, podendo reagir caso o estímulo seja intenso (p. ex., 250 g de ACTH). O teste com hipoglicemia induzida pela administração de insulina IV baseia-se no princípio de que a hipoglicemia estimula a secreção de ACTH, causando um aumento nos seus níveis e nos níveis de cortisol (resposta normal > 18 g/dL) apenas em indivíduos sem lesão hipofisária ou hipotalâmica. O cortisol é medido antes da administração de insulina (0,1 U/kg) e após 30, 60, 90 e 120 minutos, e a glicemia deve atingir o nível de 40 mg/dL ou menos. Esse teste é útil nos casos em que se quer observar concomitância com deficiência de GH, mas apresenta os riscos inerentes à hipoglicemia e é contraindicado em pacientes com cardiopatia isquêmica ou história de convulsões.
Avaliação por imagem
A tomografia computadorizada (TC) de abdome deve ser realizada nos casos de IS primária. O achado de calcificações ou aumento bilateral das suprarrenais elimina o diagnóstico de suprarrenalite autoimune e sugere o de doenças infecciosas, hemorrágicas ou neoplásicas (Fig. 31.5). Um raio X de tórax deve ser solicitado para avaliar a presença de tuberculose ou doenças fúngicas. A punção aspirativa de suprarrenal guiada por TC pode auxiliar na determinação da causa da IS. Nos casos de IS secundária ou terciária, a ressonância magnética (RM) de sela túrcica deve ser realizada.

Figura 31.5
TC de abdome em paciente com hemorragia suprarrenal bilateral (setas) após uso de enoxaparina.
Tratamento
Orientaçãoaopaciente. O paciente e seus familiares devem ser orientados quanto à importância do tratamento e de portar consigo uma pulseira ou documento que informe o diagnóstico de IS, bem como uma dose de glicocorticoide injetável nos casos de emergência (trauma grave, como queimaduras ou atropelamentos) (Tab. 31.1).
Crise suprarrenal. Não se deve esperar o diagnóstico definitivo para iniciar o tratamento em pacientes com doença aguda. Pode-se coletar uma amostra de sangue para exames futuros e imediatamente iniciar o tratamento com reposição volêmica (1 a 3 L de soro fisiológico 0,9% nas primeiras 12 a 24 horas), controlando diurese e status volêmico. Em paciente sem o diagnóstico prévio de IS, administração de dexametasona intravenosa (bólus com 4 mg) é preferível por não interferir na medida de cortisol sérico. Já nos pacientes que estavam em tratamento com glicocorticoides, qualquer preparação intravenosa pode ser utilizada (dexametasona, 4 mg, ou hidrocortisona, 100 mg), sendo preferível hidrocortisona para aqueles com potássio elevado. Tal medida rapidamente reduz a produção inapropriada de vasopressina, aumentando a excreção de água livre e corrigindo a hiponatremia. O corticoide intravenoso pode ser reduzido em 1 a 3 dias com substituição para dose de manutenção por via oral. Não é necessária a reposição aguda de mineralocorticoide devido à demora no início de seu efeito. Esta pode ser iniciada quando a infusão venosa salina não mais for necessária.
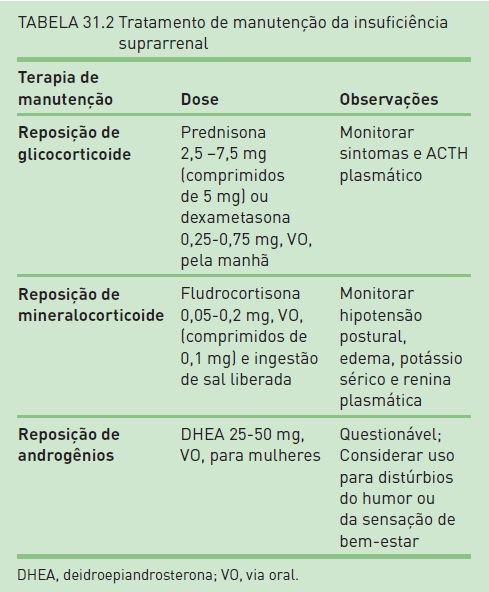
Tratamento de manutenção. O tratamento de manutenção é baseado na educação do paciente sobre sua doença, na reposição de corticosteroides, de mineralocorticoides e possivelmente de androgênios em algumas mulheres (Tab. 31.2).
Caso Clínico Comentado
A paciente desse caso apresenta IS primária, tendo como causa a suprarrenalite autoimune. A presença de hiponatremia e hipercaliemia com as manifestações clínicas apresentadas gerou suspeita de IS de etiologia primária, uma vez que há envolvimento do eixo mineralocorticoide (presença dos distúrbios hidreletrolíticos e alteração de volemia). A dosagem baixa de cortisol e elevada de ACTH confirma a origem primária. A etiologia da IS primária é a suprarrenalite autoimune, confirmada por meio de dosagem no anticorpo contra a 21-hidroxilase. A coexistência com doença tireoidiana autoimune (presença de altos títulos de anti-TPO) corrobora a etiologia, sugerindo a presença da síndrome poliglandular autoimune.

Leituras Recomendadas
Arlt W. The approach to the adult with newly diagnosed adrenal insufficiency. J Clin Endocrinol Metab. 2009;94(4):1059-67.
Arlt W, Allolio E. Adrenal insufficiency. Lancet. 2003;361(9372):1881-93.
Bornstein RS. Predisposing factors for adrenal insufficiency. N Engl J Med.2009;360(22):2328-39.
Bouillon R. Acute adrenal insufficiency. Endocrinol Metab Clin North Am.2006;35(4):767-75.
Gurnell EM, Hunt PJ, Curran SE, Conway CL, Pullenayegum EM, Huppert FA, et al. Long-term DHEA replacement in primary adrenal insufficiency: a randomized, controlled trial. J Clin Endocrinol Metab.2008;93(2):400-9.
Kazlauskaite R, Evans AT, Villabona CV, Abdu TA, Ambrosi B, Atkinson AB, et al. Corticotropin tests for hypothalamic-pituitary- adrenal insufficiency: a metaanalysis. J Clin Endocrinol Metab. 2008;93(11):4245-53.
Kronenberg HM, Melmed S, Polonsky KS, Larsen PR. Williams textbook of endocrinology. 11th ed. Philadelphia: W.B. Saunders; 2008.
Magnotti M, Shimshi M. Diagnosing adrenal insufficiency: which test is best--the 1-microg or the 250-microg cosyntropin stimulation test? Endocr Pract. 2008;14(2):233-8.
Perry R, Kecha O, Paquette J, Huot C, Van Vliet G, Deal C. Primary adrenal insufficiency in children: twenty years experience at the Sainte-Justine Hospital, Montreal. J Clin Endocrinol Metab. 2005;90(6):3243-50.
Reisch N, Arlt W. Fine tuning for quality of life: 21st century approach to treatment of Addison’s disease. Endocrinol Metab Clin North Am.2009;38(2):407-18.
Wade M, Baid S, Calis K, Raff H, Sinaii N, Nieman L. Technical details influence the diagnostic accuracy of the 1 µACTH stimulation test. Eur J Endocrinol. 2010;162(1):109-13.