Câncer de pâncreas
Caso Clínico
Uma paciente do sexo feminino, 48 anos, branca, procura o serviço de emergência devido a um quadro de icterícia, colúria e acolia iniciado há uma semana. A paciente relata dor lombar, inapetência e perda ponderal de 20 kg nos últimos seis meses. Ela afirma não ter apresentado doenças prévias.
Ao realizar exame, verifica-se que a paciente está emagrecida, ictérica e com sinais vitais normais. Os exames cardiovascular e pulmonar evidenciam normalidade. Abdome: globoso, ruídos hidroaéreos aumentados, com fígado palpável a 2 cm do rebordo costal, baço palpável à inspiração profunda e presença de macicez móvel. Na investigação complementar, não são constatadas alterações no raio X de abdome agudo; o hemograma evidencia anemia microcítica e hipocrômica e colestas e extra-hepática significativa (bilirrubina total de 28,6 mg/dL; bilirrubina direta 20,0 mg/dL; gama-glutamil-transferase [GGT] 1230 U/L; fosfatase alcalina de 300 U/L; alanino-aminotransferase [ALT] de 95 UI/L; aspartato-aminotransferase [AST] de 100 UI/L). Na ultrassonografia de abdome, há dilatação das vias biliares intra e extra-hepáticas, e, na topografia da cabeça do pâncreas, observa-se grande massa, além de trombose das veias esplênica e mesentérica superior. A partir da tomografia computadorizada de abdome, verificam-se ascite volumosa e massa de 8,0 x 7,0 x 6,0 cm em corpo/cabeça do pâncreas, invadindo as veias esplênica e mesentérica superior e sem plano de clivagem com a artéria mesentérica superior e tronco celíaco (Fig. 63.1).
Definição
Mais de 95% das neoplasias malignas do pâncreas surgem nas células exócrinas (acinares e ductais), sendo que o adenocarcinoma ductal e suas variantes são responsáveis por 80 a 90% de todas as neoplasias malignas do pâncreas exócrino. Considerando sua alta prevalência em relação aos outros tipos histológicos de câncer, este capítulo aborda apenas o adenocarcinoma de pâncreas.
Epidemiologia
Nos Estados Unidos, estima-se que sejam diagnosticados 37 mil novos casos de adenocarcinoma de pâncreas anualmente, sendo a quarta causa de morte relacionada ao câncer nesse país.1 Devido ao fato de a maioria dos casos apresentar sintomas tardiamente, apenas 10 a 15% dos pacientes diagnosticados podem realizar ressecção cirúrgica. Dos 85 a 90% restantes, 40% apresentam doença localmente avançada, e 45%, doença metastática.2 O prognóstico é ruim, mesmo nos pacientes com doença potencialmente ressecável – sobrevida de cinco anos para 25 a 30% dos pacientes com linfonodos negativos e para 10% dos pacientes com linfonodos positivos.3 A sobrevida global em cinco anos após o diagnóstico não passa de 4%.4
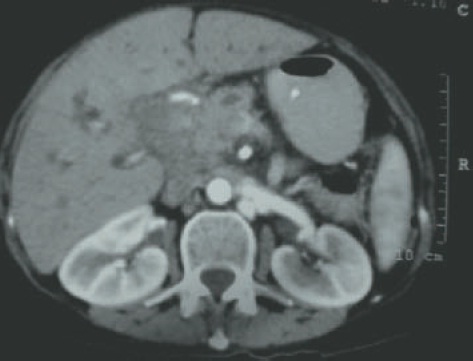
Figura 63.1
Tomografia computadorizada de abdome com grande lesão.
450
Fatores de risco
O câncer de pâncreas afeta mais homens e negros, sendo que 80% dos pacientes estão na faixa etária entre 60 e 80 anos. Outros fatores de risco incluem história de pancreatite crônica, tabagismo, história familiar de câncer de pâncreas e exposição ocupacional a carcinógenos.5 Consumo abusivo de carne e gorduras e realização de gastrectomia prévia (mais de 20 anos) também são relacionados ao aumento de risco.6
Patogênese
Existem três tipos de células pancreáticas: células acinares (80% do volume da glândula), ductais (10 a 15% do volume da glândula) e endócrinas, também denominadas ilhotas pancreáticas (1 a 2% do volume da glândula) (Fig. 63.2). Como comentado anteriormente, mais de 95% das neoplasias malignas do pâncreas surgem nas células exócrinas (acinares e ductais). Cerca de 70% das neoplasias malignas ductais originam-se na cabeça ou no processo uncinado, 20%, no corpo, e 10%, na cauda do pâncreas.4,5 Macroscopicamente, apresentam-se como nódulos endurecidos, irregulares, amarelo-acinzentados. A partir da microscopia, são evidenciados halo de pancreatite crônica ao redor do tumor, invasão linfática e vascular e frequentemente intensa reação desmoplásica e fibrose. A principal característica da neoplasia é o crescimento perineural.
Sinais e Sintomas
A manifestação de sinais e sintomas da neoplasia maligna do pâncreas é geralmente tardia e depende da localização do tumor (Tab. 63.1).
Neoplasia maligna da cabeçado pâncreas. Nesse caso, ocorre icterícia obstrutiva, perda ponderal significativas, dor abdominal ou na região dorsal (esta com pior prognóstico – geralmente há envolvimento de nervos) e colangite. Um achado semiológico não muito comum, mas bastante sugestivo é o sinal de Courvoisier, caracterizado por uma vesícula biliar palpável, não dolorosa, em pacientes ictéricos.
Neoplasia maligna do corpo e da cauda do pâncreas.Perda ponderal e dor são os sintomas que ocorrem mais frequentemente. A icterícia é uma manifestação mais rara, devido à distância da via biliar principal. Os pacientes com esse tipo de localização tumoral apresentam pior prognóstico, uma vez que os sintomas são menos específicos e, por vezes, pouco valorizados, resultando em um diagnóstico tardio em comparação ao de pacientes com câncer na cabeça do pâncreas, que apresentam icterícia logo no início dos sintomas.
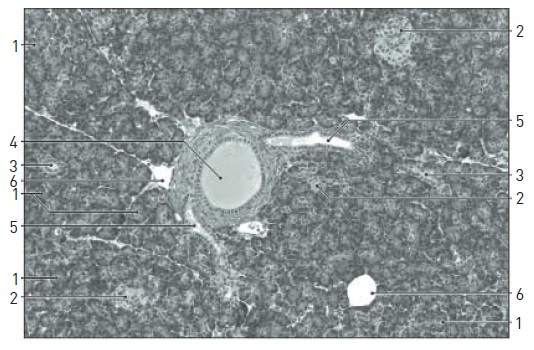
Figura 63.2
Histologia pancreática normal.
1, Ácinos. 2, Ilhotas. 3, Ductos intralobulares. 4, Ducto interlobular. 5, Dois ductos intralobulares saindo do lóbulo para juntar-se a um ducto interlobular. 6, Adipócitos.
Fonte: Ross e colaboradores.7

Diagnóstico
Exames laboratoriais
A icterícia obstrutiva (ou colestase extra-hepática) é caracterizada por aumento nos níveis de bilirrubinas totais, com predomínio de bilirrubina direta, além de fosfatase alcalina e gamaglutamiltransferase, podendo haver pouca elevação nos níveis de transaminases (ALT e AST). Anemia e hipoalbuminemia também podem ocorrer, mas em geral estão associadas à doença avançada. Ainda não existe um marcador tumoral sérico para a doença, embora alguns estejam sendo estudados. O CA 19-9 é o mais estudado no momento, e seus valores estão elevados na maioria dos pacientes com câncer de pâncreas. Embora vários estudos tentem indicá-lo como exame de rastreamento, sua confiabilidade não é alta, o que o torna insuficiente. A principal limitação desse exame é o fato de evidenciar níveis elevados em pacientes com icterícia obstrutiva de origem não neoplásica (p. ex., coledocolitíase), o que reduz sua especificidade. O CA 19-9 é bastante útil para o seguimento dos resultados terapêuticos – após ressecção completa, os níveis elevados diminuem e ficam normais, e elevam-se novamente se houver recidiva tumoral.8
Exames de imagem
Para a maioria dos pacientes, escolhe-se como exame de imagem inicial a ultrassonografia (US) abdominal, que possibilita a diferenciação do tipo de icterícia obstrutiva (coledocolitíase ou neoplasia pancreática) e também a indicação da característica da massa: sólida ou cística.5 Além disso, fornece informações representativas de doença neoplásica avançada, tais como nódulos hepáticos, linfadenomegalias, ascite e trombose venosa mesentérico-porta.4 A etapa seguinte é a realização de tomografia computadorizada (TC) de abdome com uso de contraste intravenoso. Esse exame é fundamental para estadiamento e avaliação dos critérios de ressecabilidade, os quais são abordados no tópico Tratamento. Geralmente as lesões neoplásicas apresentam-se como massas hipodensas com bordos irregulares, podendo haver necrose central.
A colangiopancreatografia endoscópica retrógrada (CPER) é indicada principalmente para os pacientes com icterícia obstrutiva sem massas identificadas na TC. O sinal do duplo ducto (dilatação dos ductos colédoco e pancreático com estenose abrupta) é característico das doenças neoplásicas.4,5 A US endoscópica (ecoendoscopia) é útil para verificação de pequenos tumores não visualizados na TC de abdome.2
Biópsia
A biópsia pode ser guiada por TC, por ecoendoscopia ou durante CPER. A função da biópsia é questionada nos casos de doença potencialmente ressecável devido a relatos de disseminação tumoral no trajeto da agulha.5 Já nos pacientes com doença irressecável, a biópsia apresenta extremo valor, pois possibilita a definição do tipo histológico da lesão e do consequente esquema quimioterápico.
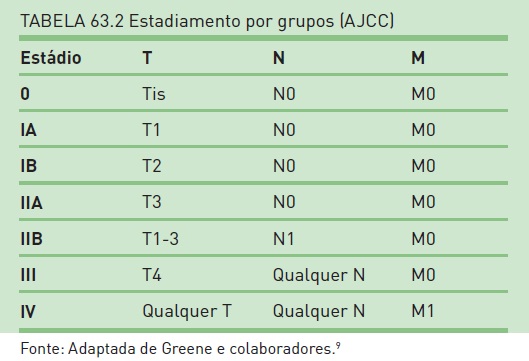
Estadiamento
O estadiamento mais utilizado na atualidade é o da American Joint Committee on Cancer (AJCC), que leva em consideração a classificação TNM (Quadro 63.1 e Tab. 63.2). Os tumores T1 e T2 ocorrem no pâncreas e são ressecáveis. Os tumores T3 são potencialmente ressecáveis, pois não envolvem nem o tronco celíaco, nem a artéria mesentérica superior. Os tumores T4 são localmente avançados e, por isso, irressecáveis. As lesões N1 apresentam linfonodos metastáticos. As metástases à distância mais comuns são verificadas no fígado, na cavidade peritoneal e nos pulmões.9
Tratamento
Tratamento curativo
Cirúrgico
O tratamento cirúrgico é o único com potencial curativo. Infelizmente, apenas uma minoria dos pacientes é passível de cura cirúrgica, uma vez que a grande maioria apresenta critérios radiológicos de irressecabilidade: metástases, envolvimento da artéria mesentérica superior ou do tronco celíaco, comprometimento da veia mesentérica superior ou da veia porta ou comprometimento da aorta ou da veia cava inferior.2
O estadiamento final é realizado por meio de laparoscopia (em casos selecionados) ou durante laparotomia, em que os linfonodos hepáticos e os locais (peripancreáticos) são biopsiados. Caso haja confirmação de neoplasia nesses linfonodos, a cirurgia com intenção curativa não pode mais ser indicada.
O procedimento de escolha é a duodenopancreatectomia, também denominada cirurgia de Whipple (Fig. 63.3), na qual são ressecados a porção cefálica do pâncreas, o colédoco com vesícula biliar, o antro gástrico, o duodeno e alguns centímetros do jejuno proximal. Alguns centros aplicam a cirurgia de Whipple modificada, na qual o piloro é preservado. Os dois procedimentos apresentam taxas de sobrevida e de morbidade semelhantes, sendo que a última é tecnicamente mais fácil, embora esteja associada a uma maior incidência de gastroparesia.5
A cirurgia de Whipple é um procedimento que acarreta altas taxas de morbimortalidade aos pacientes. As principais complicações são deiscências anastomóticas, abscesso intra-abdominal e fístulas pancreática e biliar. Quando realizada em centros especializados, a taxa de mortalidade operatória é no máximo de 5%.6

Quimiorradioterapia
Terapia adjuvante n A quimioterapia (Tab. 63.3), com ou sem radioterapia, apresenta um potencial benefício na so brevida de pacientes inicialmente submetidos à ressecção cirurgia com intenção curativa. Contudo, não existe consenso acerca do melhor agente quimioterápico a ser utilizado. A realização de radioterapia junto com quimioterapia também continua sendo uma questão muito debatida. Nos Estados Unidos, é comum o uso de quimioterapia (5-FU) e radioterapia como terapia adjuvante. Entretanto, na Europa e em outras partes do mundo, a terapia é mais comumente composta apenas de 5-FU sem radioterapia.
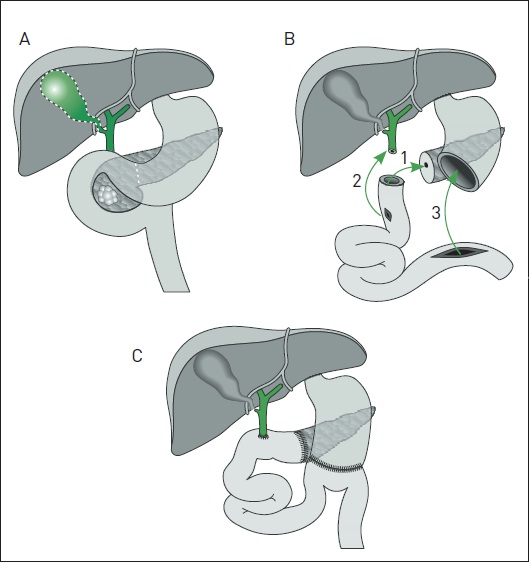
Figura 63.3
Duodenopancreatectomia (cirurgia de Whipple).
(A) Relações anatômicas pré-operatórias que evidenciam um tumor na cabeça do pâncreas. As linhas pontilhadas determinam o nível de ressecção da cirurgia de Whipple clássica (não modificada). (B) Foram ressecados estômago distal, duodeno, cabeça do pâncreas, colédoco terminal e vesícula biliar. Anastomose pancreatojejunal (1), anastomose biliodigestiva (2) e anastomose gastrojejunal (3). (C) Resultado final da cirurgia.
Fonte: Modificada de Reber.10
Tratamento paliativo
Cirúrgico
A maioria dos casos, nesse grupo, é de pacientes que realizaram a laparotomia com intenção curativa, mas que apresentaram indícios de doença avançada no transoperatório.5 Os principais sintomas que justificam uma intervenção cirúrgica são obstrução duodenal, obstrução biliar, hemorragia e dor.2 A cirurgia proporciona derivação biliodigestiva, derivação gástrica, biópsia pancreática e alcoolização do plexo celíaco.4 Em uma revisão sistemática, Yan e colaboradores11 observam que, para pacientes com doença irresssecável, a alcoolização do plexo celíaco está associada à melhora da dor e à redução das doses de opioides, além de melhora da constipação relacionada ao uso crônico de opioides. A obstrução da via biliar também pode ser resolvida com colocação de stent por via endoscópica, mas esse procedimento é restrito aos pacientes com baixa sobrevida, considerando o alto índice de obstrução da prótese com o passar dos meses.2 Até o momento, não há evidências de que a derivação gástrica em pacientes assintomáticos seja benéfica, com exceção de casos nos quais a doença é irressecável durante laparotomia.12
Quimiorradioterapia
O erlotinibe, em combinação com a gencitabina, é indicado como tratamento de primeira linha para pacientes com câncer de pâncreas localmente avançado, irressecável ou metastático (Tab. 63.3).
O Leucovorin® é uma forma de ácido fólico derivada do tetra-hidrofolato. Pode ser utilizado para potencializar o efeito do 5-FU, como comentado na Tabela 63.3. Pode ser utilizado também para reverter a mielossupressão causada pelo metotrexato. O Leucovorin® é uma forma de ácido fólico que não depende da di-hidrofostato redutase para sua ativação.
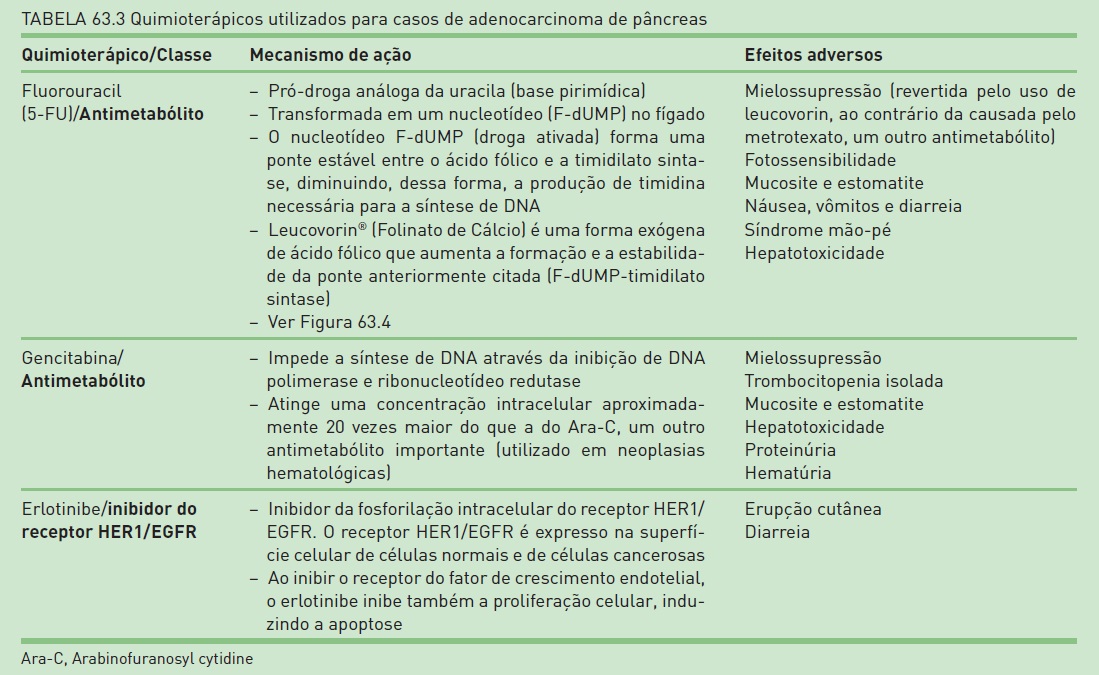
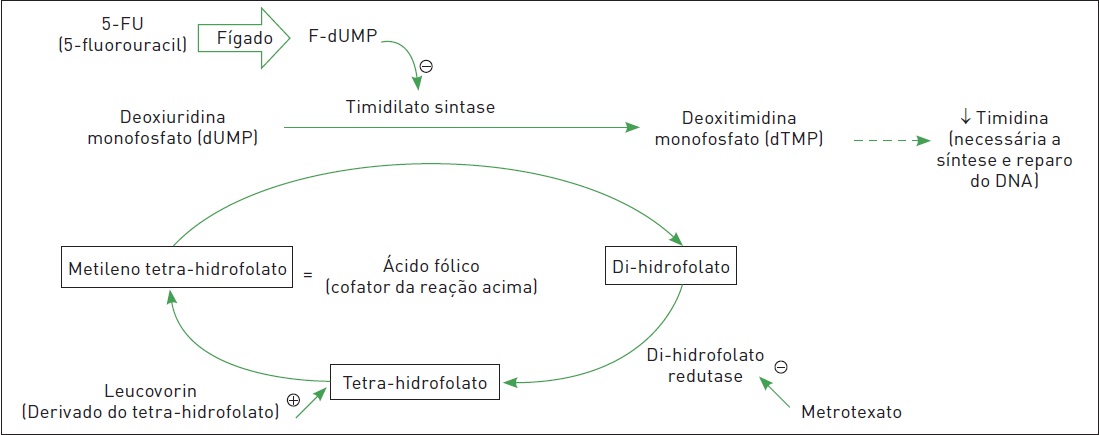
Figura 63.4
Mecanismo de ação dos antimetabólitos 5-fluorouracil e metrotexato e do Leucovorin®.
Fonte: Adaptada de Le e colaboradores.13
Caso Clínico Comentado
Na tentativa de descomprimir a via biliar, a paciente foi submetida à CPER, que evidenciou massa tumoral invadindo a segunda porção duodenal, de forma a impossibilitar a canalização da papila de Vater e a posterior colocação de prótese. No dia seguinte, a paciente desenvolveu um quadro de colangite – febre com calafrios, dor no hipocôndrio direito e icterícia (tríade de Charcot). Considerando a impossibilidade de descomprimir a via biliar por via duodenal, optou-se por drenagem percutânea, associada ao uso de antibióticos IV. A paciente apresentou melhora do quadro infeccioso, mas, em poucos dias, teve episódios de vômitos significativos, decorrentes de invasão duodenal. Após longa discussão com a paciente e familiares, escolheu-se realizar laparotomia para proceder à anastomose biliodigestiva e à gastrenteroanastomose. Durante a laparotomia, foram verificadas ascite volumosa e grande massa pancreática aderida ao tronco celíaco e à artéria mesentérica superior. A paciente faleceu 30 dias após a cirurgia. O exame anatomopatológico evidenciou adenocarcinoma ductal de pâncreas.
Entre os fatores de risco estudados anteriormente, a paciente apresentava apenas a pele negra. A sua faixa etária não era a mais comum, e sua sintomatologia inicial (dor lombar, inapetência e perda ponderal) poderia estar relacionada a outras doenças. O fato de ter manifestado inicialmente icterícia na evolução clínica indica crescimen to tumoral significativo, com progressão do corpo para a cabeça do pâncreas. Como na maioria dos casos de tumores de corpo pancreático, o diagnóstico foi tardio, impossibilitando tratamento curativo. Entre os tratamentos paliativos, a paciente optou pela cirurgia, pois era a única chance de restabelecer a via oral, o que permitiria uma recuperação do seu estado nutricional para ser submetida a tratamento quimioterápico com erlotinibe associado à gencitabina.
Referências
1.Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. Cancer J Clin. 2007;57(1):43-66.
2.Cardenes HR, Chiorean EG, Dewitt J, Schmidt M, Loehrer P. Locally advanced pancreatic cancer: current therapeutic approach. Oncologist.2006;11(6):612-23.
3.del Castillo CF. Clinical manifestations, diagnosis, and staging of exocrine pancreatic cancer [Internet]. Waltham: UpToDate; 2012 [capturado em 5 set. 2012]. Disponível em: http://www.uptodate.com/contents/clinical-manifestations-diagnosis-and-staging-of-exocrine-pancreatic-cancer. Acesso restrito.
4.Costa MSB, Osvaldt AB, Rohde L. Carcinoma do pâncreas e outras neoplasias periampulares. In: Rohde L, editor. Rotinas em cirurgia digestiva. Porto Alegre: Artmed; 2005. p. 401-7.
5.Steer ML. Exocrine pancreas. In: Townsend CM, Beauchamp RD, Evers BM, Mattox KL, editors. Sabiston text book of surgery: the biological basis of modern surgical practice. 17th ed. Philadelphia: Elsevier; 2004. p. 1667-78.
6.Doherty GM, Way LW. Pancreas. In: Doherty GM, editor. Current surgical diagnosis and treatment. 12th ed. New York: Lange; 2006.p.620-3.
7.Ross MH, Pawlina W., Larnash TA. Atlas de histologia descritiva. Porto Alegre: Artmed; 2012.
8.Goonetilleke KS, Siriwardena AK. Systematic review of carbohydrate antigen (CA 19-9) as a biochemical marker in the diagnosis of pancreatic cancer. Eur J Surg Oncol. 2007;33(3):266-70.
9.Greene FL, Page DL, Fleming ID, Fritz A, Balch CM, Haller DG, et al., editors. AJCC cancer staging handbook. 6th ed. New York: Springer; 2002. p. 179-88.
10.Reber HA. Pancreaticoduodenectomy (Whipple procedure): techniques[Internet]. Waltham: UpToDate; 2012 [capturado em 5 set. 2012]. Disponível em: http://www.uptodate.com/contents/pancreatico-duodenectomy-whipple-procedure-techniques. Acesso restrito.
11.Yan BM, Myers RP. Neurolytic celiac plexus block for pain control in unresectable pancreatic cancer. Am J Gastroenterol. 2007;102(2):430-8.
12.Lillemoe KD, Cameron JL, Hardacre JM, Sohn TA, Sauter PK, Coleman J, et al. Is prophylactic gastrojejunostomy indicated for unresectable periampullary cancer? A prospective randomized trial. Ann Surg.1999;230(3):322-8.
13.Le T, Bhushan V, Tolles J. First Aid for the USMLE Step 1 2011. New York: McGraw-Hill; 2011.